足量的镁粉与一定质量的盐酸反应,由于反应速率太快,若要减慢反应速率,但不影响产生氢气的总质量,可以加入下列物质中的
| A.加入更稀的盐酸溶液 | B.NaOH |
| C.K2CO3 | D.CH3COONa |
10 mol浓度为1mol•L-1的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气的生成的是
| A.NaHCO3 | B.CH3COONa | C.CuSO4 | D.Na2CO3 |
对于反应N2+O2 2NO,在密闭容器中进行,下列条件能使该反应的逆反应速率加快的是
2NO,在密闭容器中进行,下列条件能使该反应的逆反应速率加快的是
| A.缩小体积使压强增大 |
| B.压强不变充入He使体积增大 |
| C.体积不变充入He使压强增大 |
| D.压强不变充入N2使体积增大 |
下列说法中,正确的是
| A.0.1 mol•L-1HCl和0.1 mol•L-1H2SO4与2mol•L-1NaOH溶液反应,其反应速率相同 |
| B.大理石块与大理石粉分别同0.1 mol/L盐酸反应,其反应速率相同 |
| C.Mg、Al在相同条件下分别与0.1 mol/L盐酸反应,其反应速率相同 |
| D.0.1 mol/L HCl和0.1 mol/L HNO3与相同形状和大小的大理石反应,其反应速率相同 |
(原创)下列说法不正确的是( )
| A.中和热测定实验中,应迅速将NaOH溶液和盐酸在测定装置中混合 |
| B.为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 |
| C.探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL 5%H2O2和1mL H2O,向另一支试管中加入2mL 5%H2O2和1mL FeCl3溶液,观察并比较实验现象 |
D.已知 ,为了利用该反应探究反应速率与温度的关系,所用试剂除1 mol·L-1KI溶液、0.1 mol·L-1稀硫酸外,还需要用到淀粉溶液 ,为了利用该反应探究反应速率与温度的关系,所用试剂除1 mol·L-1KI溶液、0.1 mol·L-1稀硫酸外,还需要用到淀粉溶液 |
将ag块状碳酸钙跟足量盐酸反应,反应损失的质量随时间的变化曲线如下图的实线所示。在相同条件下,将bg(a>b)粉末状碳酸钙与同浓度盐酸反应,则相应的曲线(图中虚线所示)正确的是( )

关于下列图示的说法中正确的是:
| A.图①装置用于分离沸点相关较大的互溶液体混合物 |
| B.图②装置用于研究不同催化剂对反应速率的影响 |
| C.图③中电流计的指针发生偏转,石墨为正极 |
| D.图④装置可用于检验溴乙烷与NaOH的醇溶液共热产生的乙烯 |
化学反应速率是描述化学反应进行快慢程度的物理量。下面是某同学测定化学反应速率并探究其影响因素的实验。
Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率。(已知:S2O32-+2H+===H2O+S↓+SO2↑)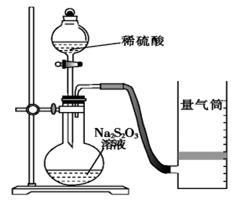
(1)为保证实验准确性、可靠性,利用该装置进行实验前应先进行的步骤是_____________________;除如图装置所示的实验用品、仪器外,还需要的一件实验仪器是______________。
(2)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是________________________。
(3)试简述测定该反应的化学反应速率的其他方法:__________________(写一种)。
Ⅱ.为探讨化学反应速率的影响因素,设计的实验方案如下表。
(已知 I2+2S2O32-===S4O62-+2I-,其中Na2S2O3溶液均足量)
| 实验序号 |
体积V/mL |
时间/s |
|||
| Na2S2O3溶液 |
淀粉溶液 |
碘水 |
水 |
||
| ① |
10.0 |
2.0 |
4.0 |
0.0 |
t1 |
| ② |
8.0 |
2.0 |
4.0 |
2.0 |
t2 |
| ③ |
6.0 |
2.0 |
4.0 |
Vx |
t3 |
(4)该实验进行的目的是_____________淀粉溶液的作用是____________。表中Vx==_______mL,比较t1、t2、t3大小,试推测该实验结论:___________________________
升高温度能使反应速率加快,下列叙述正确的是( )
| A.降低反应所需的活化能 |
| B.使反应体系的活化分子百分数增大 |
| C.体系中活化分子总数不变 |
| D.对于吸热反应、放热反应,反应速率同等程度加大 |
100mL 4mol/L 稀硫酸与2g锌粒反应,在一定温度下为了减缓反应的速率,但又不影响生成氢气的总量,可向反应物中加入( )
| A.硫酸钠固体 | B.硫酸铜固体 | C.硝酸钾溶液 | D.氯化钠溶液 |
100 mL 6 mol/L H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速度,但又不影响生成氢气的总量,不可向反应物中加入适量的( )
| A.碳酸钠(固体) | B.水 |
| C.硫酸钾溶液 | D.CH3COONa(固体) |
某反应的△H=+100kJ/mol,下列有关该反应的叙述正确的是
| A.正反应活化能小于100kJ•mol-1 |
| B.正反应活化能不小于100kJ•mol-1 |
| C.正反应活化能比逆反应活化能大100kJ•mol-1 |
| D.逆反应活化能一定小于100kJ•mol-1 |
下列说法正确的是
| A.活化分子碰撞即发生有效碰撞 |
| B.升高温度会加快反应速率,原因是增加了活化分子的碰撞次数 |
| C.某一反应的活化分子百分数是个定值 |
| D.活化分子的碰撞不一定是有效碰撞 |
下列说法中有明显错误的是( )
| A.对有气体参加的反应,增大压强,体系体积减小,可使单位体积内活化分子数增加,反应速率增大 |
| B.活化分子之间发生的碰撞一定为有效碰撞 |
| C.升高温度,一般可使活化分子的百分数增大,因而反应速率增大 |
| D.加入适宜的催化剂,可使活化分子的百分数大大增加,从而增大反应速率 |
某酸性工业废水中含有K2Cr2O7。光照下,草酸H2C2O4能将其中的Cr2O72—转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始c(H+)和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
| 实验编号 |
初始c(H+) |
废水样品体积/mL |
草酸溶液体积/mL |
蒸馏水体积/mL |
| ① |
1.0×10—4 |
60 |
10 |
30 |
| ② |
1.0×10—5 |
60 |
10 |
30 |
| ③ |
1.0×10—5 |
60 |
|
|
测得实验①和②溶液中的Cr2O72—浓度随时间变化关系如图所示。

(2)上述反应后草酸被氧化为 (填化学式)。
(3)实验①和②的结果表明 ;
实验①中0~t1时间段反应速率 (Cr3+)= mol·L—1·min—1 (用代数式表示)。
(Cr3+)= mol·L—1·min—1 (用代数式表示)。
(4)该课题组对铁明矾[Al2Fe(SO4)4·24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一: 起催化作用;假设二: ;假设三: ;
起催化作用;假设二: ;假设三: ;
(5)请你设计实验验证上述假设一,完成下表中内容。(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。溶液中Cr2O72—的浓度可用仪器测定)
| 实验方案(不要求写具体操作过程) |
预期实验结果和结论 |
| |
|