在温度相同,压强分别为p1和p2的条件下,A(g)+2B(g) nC(g)的反应体系中,C的百分含量与时间t的曲线如图所示,下列结论正确的是( )
nC(g)的反应体系中,C的百分含量与时间t的曲线如图所示,下列结论正确的是( )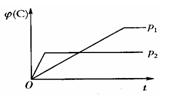
| A.p1>p2 ,n<3 | B.p1<p2 ,n>3 |
| C.p1>p2 ,n>3 | D.p1<p2 ,n<3 |
对于反应:C(S) + H2O(g) CO(g) + H2(g) △H>0,为了提高C(S)的转化率,可采取的措施是( )
CO(g) + H2(g) △H>0,为了提高C(S)的转化率,可采取的措施是( )
| A.升高反应温度 | B.降低反应温度 |
| C.增大压强 | D.再加入一些C(S) |
放热反应2NO (g) + O2 (g)  2NO2 (g) 达平衡后,若分别采取下列措施:
2NO2 (g) 达平衡后,若分别采取下列措施:
①增大压强 ②减小NO2的浓度 ③增大NO浓度 ④降低温度 ⑤加入催化剂,能使平衡正向移动,且NO转化率提高的是 ( )
| A.①②④ | B.②③④ | C.③④⑤ | D.①③⑤ |
可逆反应mA(g)+nB(g) pC(g)+ gD(g)的v-t图象如下图甲,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如下图乙。
pC(g)+ gD(g)的v-t图象如下图甲,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如下图乙。
①a1=a2 ②a1<a2 ③b1=b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2
⑤t1>t2 ⑥t1=t2
⑦两图中阴影部分面积相等 ⑧乙图阴影部分面积更大
以上正确的为 ( )
| A.②④⑤⑦ | B.①④⑥⑧ | C.②③⑤ | D.①③⑥⑦ |
反应:X(g) + 3Y(g)  2Z(g) ;△H﹤0。在不同温度T、不同压强(P1>P2)下,达到平衡时,混和气体中Z的百分含量随温度变化的曲线应为
2Z(g) ;△H﹤0。在不同温度T、不同压强(P1>P2)下,达到平衡时,混和气体中Z的百分含量随温度变化的曲线应为
升高温度,下列数据不一定同时增大的是( )
| A.化学反应速率v | B.弱电解质的电离平衡常数Ka |
| C.化学平衡常数K | D.水的离子积常数Kw |
合成氨所需的氢气可由水煤气反应制得,其中的一步反应为: CO(g)+H2O(g) 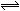 CO2(g) +H2(g);△H=-43kJ·mol-1对于上述反应,下列措施中能提高CO转化率的是
CO2(g) +H2(g);△H=-43kJ·mol-1对于上述反应,下列措施中能提高CO转化率的是
| A.增大压强 |
| B.升高温度 |
| C.增大水蒸气的浓度 |
| D.增大CO的浓度 |
反应C(s)+H2O(g) 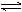 CO(g)+H2(g),在密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g),在密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
| A.保持体积不变,加入CO气体 | B.将C(s)粉碎成细小粉末 |
| C.保持体积不变,充入氩气 | D.降低反应体系温度 |
在0.1mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+对于该平衡,下列叙述正确的是
CH3COO-+H+对于该平衡,下列叙述正确的是
| A.加入少量NaOH固体,平衡向逆反应方向移动 |
| B.升高温度,平衡向正反应方向移动 |
| C.加入水稀释,溶液中c(H+)一定增大 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
某温度时,AgCl在水中的沉淀溶解平衡曲线如图所示(提示:AgCl(s) Ag+(aq)+Cl-(aq),其平衡常数Ksp=c(Ag+)·c(Cl-),称为溶度积常数;又知:
Ag+(aq)+Cl-(aq),其平衡常数Ksp=c(Ag+)·c(Cl-),称为溶度积常数;又知:
Ksp(AgCl)=1.8×10-10,Ksp(Ag2S)=6.3×10-50)。下列说法正确的是: ( )
| A.加入NaCl可以使溶液由a点变到b点 |
| B.b点和d点均无AgCl沉淀生成 |
| C.a点对应的Ksp大于c点对应的Ksp |
D.向0.1mol/L的硝酸银溶液中滴加0.1mol/L的NaCl溶液至不再有白色沉淀生成,再向其中滴加0.1mol/L的Na2S溶液,白色沉淀转化为黑色沉淀。其沉淀转化的反应方程式为:2AgCl(s)+S2-(aq) Ag2S(s)+2Cl-(aq) 。 Ag2S(s)+2Cl-(aq) 。 |
在C(s)+CO2(g)  2CO(g)反应中,可使反应速率增大的措施是( )
2CO(g)反应中,可使反应速率增大的措施是( )
①增大压强 ②增加碳的量 ③通入CO2 ④恒压下充入N2
⑤恒容下充入N2 ⑥通入CO
| A.①③④ | B.②④⑥ | C.①③⑥ | D.③⑤⑥ |
酸性高锰酸钾溶液与草酸溶液反应的化学方程式为2 KMnO4 + 3 H2SO4 + 5 H2C2O4 = K2SO4 + 2 MnSO4 + 10 CO2↑+ 8 H2O ,下列措施不能使反应速率加快的是( )
| A.增大酸性高锰酸钾溶液的浓度 | B.增大草酸溶液的浓度 |
| C.增大压强 | D.升高温度 |
在固定容积的密闭容器中进行反应:2SO2(g)+O2(g)  2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1,0.1 mol·L-1,0.2 mol·L-1,当反应达到平衡时,各物质的浓度(mol·L-1)可以是(设趋向平衡的过程中内外无物质的交换)
2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1,0.1 mol·L-1,0.2 mol·L-1,当反应达到平衡时,各物质的浓度(mol·L-1)可以是(设趋向平衡的过程中内外无物质的交换)
| A.SO2为0.4 O2为0.2 | B.SO2为0.26 |
| C.SO2和SO3都为0.18 | D.SO3为0.4 |