广东省东莞市五校联考高二上学期期中考试化学卷
中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中不正确的是
| A.用反应物、产物中键能数据可判断对应反应的反应热 |
| B.用沸点数据推测将一些液体混合物用分镏的方法分离开来的可能性 |
| C.用反应热数据的大小判断不同反应的反应速率的快慢 |
| D.用平衡时各组分的物质的量浓度可计算一定温度下反应的平衡常数 |
下列变化属于放热反应的是 
| A.H2O(g)=H2O(l) △H=-44.0 kJ/mol |
| B.2HI(g)=H2(g)+I2(g) △H=+14.9 kJ/mol |
| C.形成化学键时放出能量的化学反应 |
| D.能量变化如右图所示的化学反应 |
下列热化学方程式书写正确的是
A.2SO2+O2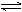 2SO3; △H=-196.6kJ/mol 2SO3; △H=-196.6kJ/mol |
| B.C(s)+O2(g)==CO2(g);△H=393.5kJ/mol |
| C.1/2H2(g)+1/2Cl2(g)==HCl(g);△H=-92.5kJ/mol |
| D.H+(aq)+OH-(aq)==H2O(l);△H=57.3kJ |
下列说法或表示方法正确的是
| A.反应物的总能量低于生成物的总能量时,该反应一定不能发生 |
| B.强酸跟强碱反应放出的热量就是中和热 |
C.由石墨比金刚石稳定可知: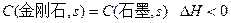 |
D.在 、 、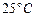 时, 时,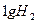 完全燃烧生成气态水,放出 完全燃烧生成气态水,放出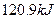 热量,则氢气的燃烧热为241.8 热量,则氢气的燃烧热为241.8 |
已知:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(1) △H= Q1kJ/mol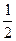 H2SO4(浓)+NaOH(aq)=
H2SO4(浓)+NaOH(aq)=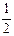 Na2SO4(aq)+H2O(1) △H= Q2kJ/mol
Na2SO4(aq)+H2O(1) △H= Q2kJ/mol
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(1) △H= Q3kJ/mol
上述反应均为溶液中的反应,则Q1、Q2、Q3的绝对值大小的关系为
| A.Q1=Q2=Q3 | B.Q2>Q1>Q3 | C.Q2>Q3>Q1 | D.Q2=Q3>Q1 |
下列有关热化学方程式的叙述正确的是
| A.已知2H2(g)+O2(g) ==2H2O(l);△H=-571.6kJ·mol-1,则H2的燃烧热为285.8kJ·mol-1 |
| B.已知4P(红磷,s)="=" P4(白磷,s);△H>0,则白磷比红磷稳定 |
| C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为: NaOH(aq)+CH3COOH(aq) ="=" CH3COONa(aq) + H2O(l) △H =-57.4kJ·mol-1 |
| D.已知2C(s)+2O2(g)=2CO2(g) △H1;2C(s)+O2(g)="2CO(g)" △H2,则△H1>△H2 |
下列说法中正确的是
| A.已知:2H2O(l)= 2H2(g)+O2(g);△H1>0 H2O(l)=H2(g)+1/2 O2(g);△H2>0则△H1>△H2 |
| B.在合成氨工业生产中,为提高氢气的转化率,可采取使用催化剂的措施 |
| C.因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N |
| D.热量可能自发地从低温物体传递到高温物体 |
反应C(s)+H2O(g) 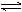 CO(g)+H2(g),在密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g),在密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
| A.保持体积不变,加入CO气体 | B.将C(s)粉碎成细小粉末 |
| C.保持体积不变,充入氩气 | D.降低反应体系温度 |
在恒温、体积为2L的密闭容器中进行反应:2A(g)  3B(g)+C(g),若反应物在前20s由3mol降为1.8mol,则前20s的平均反应速度为
3B(g)+C(g),若反应物在前20s由3mol降为1.8mol,则前20s的平均反应速度为
A、v(B)="0.03mol/(L·s) " B、v(B)="0.045mol/(L·s) "
C、v(C)="0.03mol/(L·s) " D、v(C)=0.06mol/(L·s)
下列事实不能用勒夏特列原理解释的是
| A.打开汽水瓶时,有大量气泡溢出 |
| B.在配制硫酸亚铁溶液时往往要加入一定量铁粉 |
| C.氨水应密闭保存放置于低温处 |
| D.实验室用排饱和食盐水的方法收集氯气 |
向容积为2 L的密闭容器中充入2 mol A气体和1 mol B气体,在一定条件下发生如下反应:2A(g)+B(g) 3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
① 用物质A表示该反应的平均反应速率为0.2 mol·L-1·s-1
② 用物质B表示该反应的平均反应速率为0.2 mol·L-1·s-1
③ 平衡时物质A与B的转化率相等
④ 平衡时物质B的浓度为0.2 mol·L-1
| A.①②③ | B.①③ | C.②④ | D.①③④ |
将一定量的SO2和氧气放入一定体积的密容器中,550℃时在催化剂作用下发生反应:2SO2(g)+2O2 (g) 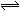 2SO3(g) (正反应放热)。下列能判断该反应达到平衡状态的标志是
2SO3(g) (正反应放热)。下列能判断该反应达到平衡状态的标志是
| A.容器中混合气体的密度保持不变 | B.每消耗1molO2的同时生成1molSO3 |
| C.容器中气体的压强不变 | D.SO3的生成速率与SO2的消耗速率相等 |
合成氨所需的氢气可由水煤气反应制得,其中的一步反应为: CO(g)+H2O(g) 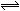 CO2(g) +H2(g);△H=-43kJ·mol-1对于上述反应,下列措施中能提高CO转化率的是
CO2(g) +H2(g);△H=-43kJ·mol-1对于上述反应,下列措施中能提高CO转化率的是
| A.增大压强 |
| B.升高温度 |
| C.增大水蒸气的浓度 |
| D.增大CO的浓度 |
在下面的自发过程中,你认为其中能用熵判据解释的是
| A.水由高处流向低处 | B.2H2(g)+O2(g)=2H2O(l) ΔH=-483.6 kJ/mol | C.墨水滴在水中会扩散到整个水体 | D.-10℃的液态水自动结冰成为固态 |
如图,条件一定时,反应
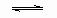 2
2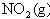 (正反应为放热)中NO的转化率R(NO)与T变化关系曲线图,图中有a、b、c、d4个点,其中表示未达到平衡状态,且
(正反应为放热)中NO的转化率R(NO)与T变化关系曲线图,图中有a、b、c、d4个点,其中表示未达到平衡状态,且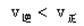 的点是
的点是 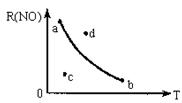
| A.a | B.b | C.c | D.d |
下列反应不属于吸热反应的是
| A.锌放入稀硫酸中 | B.高锰酸钾分解 |
| C.中和反应 | D.碳和水蒸气在高温下反应 |
从下列实验事实所引出的相应结论正确的是
| 选项 |
实验事实 |
结论 |
| A |
其他条件相同,Na2S2O3溶液浓度越大,析出硫沉淀所需要的时间越短 |
当其他条件不变时,增大反应物的浓度化学反应速率加快 |
| B |
在化学反应前后,催化剂的质量和化学性质都没有发生变化 |
催化剂一定不参加化学反应 |
| C |
H+浓度相同的盐酸和醋酸分别与等质量的形态相同的锌粒反应 |
反应开始时速率相同 |
| D |
在容积可变的密闭容器中发生反应I2(g) + H2(g)  2HI(g) ,把容积缩小一倍 2HI(g) ,把容积缩小一倍 |
正反应速率加快,逆反应速率不变 |
已知反应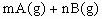
 ,A的转化率
,A的转化率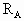 与p、T的关系如图,根据图示可以得出的正确结论是
与p、T的关系如图,根据图示可以得出的正确结论是 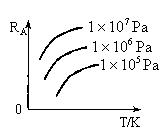
| A.正反应放热 | B.正反应吸热 |
C. |
D.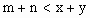 |
反应A(g)+B(g) C(g) +D(g)过程中的能量变化如图所示,则下列说法正确的是
C(g) +D(g)过程中的能量变化如图所示,则下列说法正确的是
| A.该反应是放热反应 |
| B.反应体系中加入催化剂对反应热有影响 |
| C.当反应达到平衡时,升高温度,A的转化率减小 |
| D.改变压强与加催化剂对反应的影响原因相同,都不会使平衡发生移动 |
将一定量的固体Ag2SO4置于容积不变的密闭容器中(装有少量V2O5),在一定温度下发生下列反应:① Ag2SO4(s) Ag2O(s)+SO3(g),② 2SO3(g)
Ag2O(s)+SO3(g),② 2SO3(g) 2SO2(g)+O2(g),反应经过10min后达到了平衡状态,测得c (SO3)=0.4mol/L,c (SO2)=0.1mol/L,则下列叙述中不正确的是
2SO2(g)+O2(g),反应经过10min后达到了平衡状态,测得c (SO3)=0.4mol/L,c (SO2)=0.1mol/L,则下列叙述中不正确的是
| A.容器里气体的密度为40g/L |
| B.在这10min内氧气的平均反应速率为0.05mol/(L·min) |
| C.反应②中SO3的分解率为20% |
| D.此温度下反应①的平衡常数为4 |
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: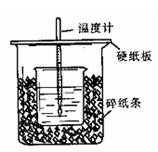
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 。
(2)烧杯间填满碎纸条的作用是 。
(3)要重复进行三次实验的目的是 。
(4)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”);当室温低于10℃时进行,对实验结果会造成较大的误差,其原因是_______ 。
(5)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由 。
(6)用相同浓度和体积的醋酸(CH3COOH)代替HCl溶液进行上述实验,测得的中和热的数值会 ;(填“偏大、偏小、无影响”)。
(7)三次平行操作所测得的数据如下:
| 温度 序号 |
起始温度t1/℃ |
终止温度 T2/℃ |
温度差 △t/℃ |
||
| HCl |
NaOH |
平均值 |
|||
| 1 |
25 |
25 |
|
27.3 |
|
| 2 |
25 |
25 |
|
27.4 |
|
| 3 |
25 |
25 |
|
28.6 |
|
若上述HCl、NaOH溶液的密度都近似为1g/cm3,中和后生成的溶液的比热容C="4.18" J/(g·℃),则实验测得的中和热为 。
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
(1)反应的热化学方程式为 。
(2)又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
(4)盖斯定律在生产和科学研究中有很重要的意义。已知把煤作为燃料可通过下列两种途径:
途径I:C(s) +O2 (g) == CO2(g) △H1<0 ①
途径II:先制成水煤气:C(s) +H2O(g) == CO(g)+H2(g) △H2>0 ②
再燃烧水煤气:2CO(g)+O2 (g) == 2CO2(g) △H3<0 ③
2H2(g)+O2 (g) == 2H2O(g) △H4<0 ④
则△H1、△H2、△H3、△H4的数学关系式是 。
在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,发生下列反应:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。
试回答下列问题:
(1)平衡时CO的转化率为 ,该反应的化学平衡常数为 。
(2)如果继续向该平衡体系中通入1.0mol的H2O(g),相同条件下反应达到新的平衡状态,则CO的转化率将 (填“增大”、“减小”、“不变”),预计CO的转化率为 。
(3)427℃时该反应的平衡常数为9.4,请结合(1)中的计算结果判断该反应的△H 0(填“>”、“=”、“<”)。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号