广东省东莞市光明、常平、厚街、万江四校高二上学期期中考试化学试卷
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生,下列属于未来新能源标准的是( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
| A.①②③④ | B.⑤⑥⑦⑧ | C.③⑤⑥⑦⑧ | D.③④⑤⑥⑦⑧ |
下列物质是强电解质的是( )
| A.CH3COOH | B.SO3 | C.NaCl | D.石墨 |
在2A(g)+B(g)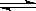 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.υ(A)= 0.5 mol/(L·s) B.υ(B)= 0.3 mol/(L·s)
C.υ(C)= 0.8 mol/(L·s) D.υ(D)= 1 mol/(L·s)
下列说法正确的是( )
| A.凡是放热反应的发生均无需加热 |
| B.凡是需要加热后才能发生的反应是吸热反应 |
| C.伴有能量变化的物质变化都是化学变化 |
| D.物质发生化学反应都伴随着能量变化 |
下列反应既属于氧化还原反应,又是吸热反应的是:( )
| A.锌粒与稀硫酸的反应 | B.灼热的木炭与CO2的反应 |
| C.甲烷在空气中燃烧的反应 | D.Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
下列热化学方程式书写正确的是( )
| A.C(s) + O2(g) ="=" CO2(g)△H= +393.5kJ/mol |
| B.2SO2 + O2 ="=" 2SO3△H=-196.6kJ/mol |
| C.H2(g) + 1/2O2(g) ="=" H2O(l)△H=-285.8kJ/mol |
| D.2H2(g) + O2(g) ="=" 2H2O(l) △H=-571.6KJ |
在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应:
A(s)+3B(g)  2C(g)+D(g) 已达平衡状态的是 ( )
2C(g)+D(g) 已达平衡状态的是 ( )
| A.混合气体的压强 | B.混合气体的密度 |
| C.A的物质的量浓度 | D.气体的总物质的量 |
对于反应:C(S) + H2O(g) CO(g) + H2(g) △H>0,为了提高C(S)的转化率,可采取的措施是( )
CO(g) + H2(g) △H>0,为了提高C(S)的转化率,可采取的措施是( )
| A.升高反应温度 | B.降低反应温度 |
| C.增大压强 | D.再加入一些C(S) |
在温度相同,压强分别为p1和p2的条件下,A(g)+2B(g) nC(g)的反应体系中,C的百分含量与时间t的曲线如图所示,下列结论正确的是( )
nC(g)的反应体系中,C的百分含量与时间t的曲线如图所示,下列结论正确的是( )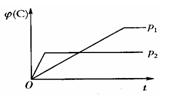
| A.p1>p2 ,n<3 | B.p1<p2 ,n>3 |
| C.p1>p2 ,n>3 | D.p1<p2 ,n<3 |
已知:(1)Zn(s)+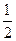 O2(g)=== ZnO(s),ΔH=" -348.3" kJ·mol-1,
O2(g)=== ZnO(s),ΔH=" -348.3" kJ·mol-1,
(2)2Ag(s)+ 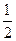 O2(g)=== Ag2O(s),ΔH=" -31.0" kJ·mol-1,
O2(g)=== Ag2O(s),ΔH=" -31.0" kJ·mol-1,
则Zn(s)+ Ag2O(s) === ZnO(s)+ 2Ag(s)的ΔH等于( )
| A.-379.3 kJ·mol-1 | B.-317.3 kJ·mol-1 |
| C.-332.8 kJ·mol-1 | D.317.3 kJ·mol-1 |
下列事实不能用勒夏特列原理解释的是( )
| A.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深 |
| B.黄绿色的氯水光照后颜色变浅 |
| C.使用催化剂可加快SO2转化为SO3的速率 |
| D.在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去 |
密闭容器中一定量的混合气体发生反应:xA(g)+yB(g)  zC(g),平衡时,测得A的浓度为0.80mol·L-1,在温度不变时,把容器容积扩大到原来的2倍,使其重新达到平衡,A的浓度为0.30mol·L-1,有关叙述正确的是( )
zC(g),平衡时,测得A的浓度为0.80mol·L-1,在温度不变时,把容器容积扩大到原来的2倍,使其重新达到平衡,A的浓度为0.30mol·L-1,有关叙述正确的是( )
| A.平衡向逆反应方向移动 | B.x + y < z |
| C.B的转化率降低 | D.C的体积分数增大 |
下列有关叙述中正确的是( )
| A.难溶于水的电解质一定是弱电解质 |
| B.强电解质的水溶液导电能力不一定比弱电解质水溶液的导电能力强 |
| C.易溶于水的电解质一定是强电解质 |
| D.强电解质在水溶液中的电离过程是不可逆的 |
25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应生成1mol水时所放出的热量约为57.3 kJ/mol;辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是( )
A.CH3COOH(aq)+NaOH(aq)="==" CH3COONa(aq)+H2O(l) 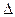 H= H= 57.3kJ/mol 57.3kJ/mol |
B.KOH(aq)+ H2SO4(aq)= H2SO4(aq)=  K2SO4(aq)+H2O(l) K2SO4(aq)+H2O(l)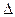 H= H= 57.3kJ/mol 57.3kJ/mol |
C.2C8H18(g)+25O2 (g)=16CO2 (g)+18H2O(1)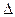 H= H= 11036 kJ/mol 11036 kJ/mol |
D.C8H18(l)+  O2 (g)=8CO2 (g)+ 9H2O(g) O2 (g)=8CO2 (g)+ 9H2O(g)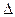 H= H= 5518 kJ/mol 5518 kJ/mol |
⑴常温、101kPa,15g乙烷完全燃烧放出的热量为390.2 kJ,则乙烷完全燃烧的热化学方程式为:
⑵把煤作为燃料可通过下列两种途径:途径Ⅰ:C(s)+O2(g)=CO2(g) ΔH1<0 ①途径Ⅱ:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g) ΔH2>0 ②
再燃烧水煤气:CO(g)+ 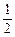 O2(g)=CO2(g) ΔH3<0 ③
O2(g)=CO2(g) ΔH3<0 ③
H2(g)+ 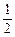 O2(g)=H2O(g) ΔH4<0 ④
O2(g)=H2O(g) ΔH4<0 ④
请回答下列问题:
①途径Ⅰ放出的热量__________(填“大于”、“等于”或“小于”)途径Ⅱ放出的热量。
②用ΔH2、ΔH3、ΔH4表示ΔH1的数学关系式是_______________
一密封体系中发生反应:N2 +3H2 2NH3 ΔH<0,
2NH3 ΔH<0,
①以下图1、图2均表示该反应在t1时达到平衡,在t2时改变某条件发生变化的曲线。
试判断,图1中t2时改变的条件是______________;图2中t2时改变的条件是____ _________。
②下图是某一时间段中反应速率与反应进程的曲线关系图:
下列各时间段时,氨的百分含量最高的是 。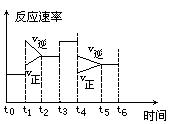
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
③工业生产中提高合成氨反应的反应速率和产率的具体措施是:
A.降低温度 B. 增大压强 C. 降低压强
D. 循环利用和不断补充氮气 E. 及时移出氨气
⑴高温下,某反应达到平衡,平衡常数K=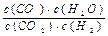 。
。
①该反应化学方程式为 。
②若恒容时,温度升高,H2浓度减小,则该反应焓变为 (填正值或负值)。
③恒温恒压下,若继续向原平衡混合物的容器中通入少量氦气(假设氦气和各物质不反应)后,化学平衡 移动;反应物的转化率 (填增大、减小、或不变);H2的浓度
(填增大、减小、或不变);
⑵可逆反应: X+ 3Y(g)  2Z(g) +2W(g)达到平衡,混
2Z(g) +2W(g)达到平衡,混
合物中Y的体积分数随压强(P)与温度T(T2>T1)的变化关系如图示。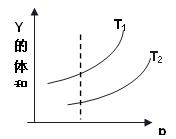
①当压强不变时,升高温度,Y的体积分数变 ,
平衡向 方向移动,则正反应是 热反应。
②当温度不变时,增大压强,Y的体积分数变 ,
平衡向 方向移动,则X的状态是
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下 列问题: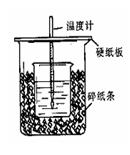
⑴从实验装置上看,图中尚缺少的一种玻璃用品是 。
⑵烧杯间填满碎纸条的作用是 。
⑶如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由 。
⑷用相同浓度和体积的醋酸溶液代替盐酸进行上述实验,测得的中和热ΔH会 。(填“偏大”、“偏小”、“无影响”)
某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内A的平均速率为_________mol/(L·min)。
(2)在实验2,A的初始浓度c2=_________mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是_________。
(3)设实验3的反应速率为υ3,实验1的反应速率为υ1,则υ3_________υ1(填>、=、<),且c3_________1.0 mol/L(填>、=、<)。
(4)比较实验4和实验1,可推测该反应是_________反应(选填吸热、放热)。理由是:
______________________________________________________________________
t℃时,将3mol A和1mol B气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g) xC(g),△H<0;在2min时反应达到平衡状态(温度不变)剩余了0.8molB,并测得C的浓度为0.4mol·L—1,请填写下列空白,并利用三段式写出①②的计算过程。
①从开始反应至达到平衡状态,求反应物A的平均反应速率和A的转化率。
②求x的值和t℃该反应的平衡常数K的值。
③若向原平衡混合物的容器中再充入4 mol C,在t℃时达到新的平衡,此时B的物质的量为n(B)= mol。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号