福建省福州市八县(市)协作校第一学期期中联考高二理科化学试卷
下述做法符合低碳生活的是( )
| A.以煤等燃料作为主要生活燃料 |
| B.利用太阳能、风能和氢能等能源替代化石能源 |
| C.鼓励私人购买和使用汽车代替公交车 |
| D.限制使用电动车 |
酸性高锰酸钾溶液与草酸溶液反应的化学方程式为2 KMnO4 + 3 H2SO4 + 5 H2C2O4 = K2SO4 + 2 MnSO4 + 10 CO2↑+ 8 H2O ,下列措施不能使反应速率加快的是( )
| A.增大酸性高锰酸钾溶液的浓度 | B.增大草酸溶液的浓度 |
| C.增大压强 | D.升高温度 |
下列反应中生成物总能量高于反应物总能量的是( )
| A.碳酸钙受热分解 | B.乙醇燃烧 |
| C.铝粉与氧化铁粉末反应 | D.氧化钙溶于水 |
在铁制品上镀上一定厚度的银层,以下电镀方案中正确的是( )
| A.银作阳极,铁制品作阴极,溶液中含Fe2+ |
| B.银作阴极,铁制品作阳极,溶液中含Ag+ |
| C.银作阴极,铁制品作阳极,溶液中含Fe3+ |
| D.银作阳极,铁制品作阴极,溶液中含Ag+ |
用惰性电极电解氯化铜溶液,反应开始时阴极和阳极上分别析出的物质是( )
| A.H2和Cl2 | B.Cu和O2 |
| C.Cu和Cl2 | D.H2和O2 |
下列叙述正确的是( )
| A.物质燃烧不一定是放热反应 |
| B.放热反应不需要从外界吸收任何能量就能发生 |
| C.在一个确定的化学反应中,反应物总能量总是高于生成物总能量 |
| D.放在冰箱中的食品保质期较长,这与温度对反应速率的影响有关 |
在如图所示的装置中,a的金属活泼性在氢前,b为碳棒,关于此装置的各种叙述不正确的是( )
| A.a是正极,b是负极 |
| B.碳棒上有气体放出 |
| C.a极上发生了氧化反应 |
| D.溶液中H+从a极移动到b极 |
有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A →B ;当A、D组成原电池时,A为正极;B与C构成原电池时,电极反应式为:
C 2—+2e—→C,B—2e—→B2+则A、B、C、D金属性由强到弱的顺序为( )
A.A>B>C>D B.A>B>D>C C.D>A>B>C D.D>C>A>B
反应A(g)+3B(g)  2C(g)在2L密闭容器中反应,半分钟内C的物质的量增加了0.6mol,有关反应速率中正确的是
2C(g)在2L密闭容器中反应,半分钟内C的物质的量增加了0.6mol,有关反应速率中正确的是
A.v(A)="0.005" mol·L-1·s-1 B.v(C)="0.02" mol·L-1·s-1
C.v(B)= v(A)/3 D..v(A)="0.01" mol·L-1·s-1
把0.6 mol气体X和0.4mol气体Y混合于2L容器中,使其发生如下反应:3X (g)+ Y(g)  nZ (g) + 2W (g),5min末生成0.2 mol W,若测得以Z浓度变化表示的平均反应速率为0.01 mol·(L·min)-1,则n的值为( )
nZ (g) + 2W (g),5min末生成0.2 mol W,若测得以Z浓度变化表示的平均反应速率为0.01 mol·(L·min)-1,则n的值为( )
| A.1 | B.2 | C.3 | D.4 |
下列事实不能用电化学理论解释的是( )
| A.轮船水线以下的船壳上镶嵌有一定量的锌块 |
| B.镀锌的铁制品比镀锡的铁制品耐用 |
| C.铁在潮湿的空气中容易腐蚀 |
| D.常温下铝跟稀硫酸快速反应,跟浓硫酸几乎不反应 |
已知热化学方程式: H2O(g)=H2(g) +1/2O2(g) △H = +241.8kJ/mol
H2(g)+ 1/2O2(g)=H2O(1) △H =" -" 285.8kJ/mol
当1g液态水变为水蒸气时,其热量变化是 ( )
| A.吸热44kJ | B.吸热2.44KJ |
| C.放热44kJ | D.放热2.44KJ |
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:
Cd(OH)2+2Ni(OH)2 Cd+2NiO(OH)+2H2O
由此可知,该电池放电时的负极材料是( )
| A.Cd(OH)2 | B.Cd |
| C.Ni(OH)2 | D.NiO(OH) |
在U形管中,用惰性电极电解硫酸钠和石蕊的混合液,可观察到的现象是()
| A.两极附近颜色无明显变化 |
| B.两极均有气体产生,且阳极所产生的气体是阴极的两倍 |
| C.阳极附近的颜色变红 |
| D.阴极附近的颜色变红 |
如图装置进行实验,关于此装置,下列的叙述正确的是( )
| A.A池是电解池 | B.Fe极是阴极 |
| C.B池是原电池 | D.B池溶液变红 |
下列关于铁电极的说法中,正确的是 ( )
| A.钢铁的吸氧腐蚀中铁是正极 | B.在铁片上镀铜时铁片作阳极 |
| C.电解饱和食盐水时可用铁作阴极 | D.镀锌铁板发生电化学腐蚀时铁是负极 |
已 知化学反应C(s)+ O2(g)==CO(g);△H=" —" Q1 kJ/mol,
O2(g)==CO(g);△H=" —" Q1 kJ/mol,
2CO (g)+O2(g)==2CO2(g);△H=" —" Q2 kJ/mol。
据此推断,下列说法正确的是(Q1、Q2均为正数,且其他条件相同)( )
| A.碳的燃烧热为Q1 kJ/mol |
| B.2molCO(g)所具有的能量一定高于2molCO2(g)所具有的能量 |
| C.一定质量的碳燃烧,生成CO2(g)比生成CO(g)时放出的热量多 |
| D.碳燃烧生成CO2气体的热化学方程式为: |
C(s)+ O2(g)==CO2(g);△H= —(Q1 +Q2)kJ/mol
在体积可变的容器中发生反应N2 + 3H2  NH3当增大压强使容器体积缩小时,化学反应速率加快,其主要原因是( )
NH3当增大压强使容器体积缩小时,化学反应速率加快,其主要原因是( )
| A.分子运动速率加快,使反应物分子间的碰撞机会增多 |
| B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多 |
| C.分子间距离减小,使所有的活化分子间的碰撞都成为有效碰撞 |
| D.活化分子百分数未变,但单位体积内活化分子数增加,有效碰撞次数增多 |
在一定条件下,C O和CH4燃烧的热化学方程式分别为:
O和CH4燃烧的热化学方程式分别为:
2CO(g) + O2(g) = 2CO2(g);△H =-566kJ/mol
CH4(g) + 2O2(g) = CO2(g) + 2H2O(l);△H =-890kJ/mol
由1molCO和3molCH4组成的混和气在上述条件下完全燃烧时,释放的热量为( )
| A.2912kJ | B.2953kJ | C.3236kJ | D.3867kJ |
已知:2H2(g)+O2(g)=2H2O (1),△H=-571.6 kJ·mol-1,下列叙述正确的是( )
| A.2mol H2完全燃烧生成水时放出571.6 kJ的热量 |
| B.1mol 液态水完全分解生成H2和O2时放出285.8kJ的热量 |
| C.2个氢分子和1个氧分子完全燃烧生成液态水时放出571.6 kJ的热量 |
D.上述热化学方程式可表示为H2(g)+ 1/2O2(g)=H 2O (1),△H=-285.8 kJ·mol-1 2O (1),△H=-285.8 kJ·mol-1 |
在C(s)+CO2(g)  2CO(g)反应中,可使反应速率增大的措施是( )
2CO(g)反应中,可使反应速率增大的措施是( )
①增大压强 ②增加碳的量 ③通入CO2 ④恒压下充入N2
⑤恒容下充入N2 ⑥通入CO
| A.①③④ | B.②④⑥ | C.①③⑥ | D.③⑤⑥ |
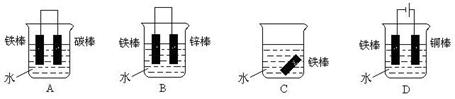
等质量的两份锌粉a、b分别加入到两份质量相同的过量的稀硫酸中,同时向a中加入少量的CuSO4溶液,b保持不变,下列各图是产生H2的体积V(L)与时间t(min)的关系,其中正确的是
在密闭容器中进行可逆反应,A与B反应生成C,其反应速率可分别用v(A)、v(B)、v(C)表示,且有如下关系:v(B)=3v(A),v(C)=2v(A),3v(C)=2v(B),则该反应的化学方程式为: .
(1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256KJ的热量。反应的热化学方程式为 。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是a kJ·mol-1,H-H键的键能是b kJ·mol-1;N-H键的键能是c kJ·mol-1。由N2和H2合成1mol NH3时可放出 kJ的热量。
某研究性学习小组欲探究原电池的形成条件,按右图所示装置进行实验并得到下表实验结果:
| 实验 序号 |
A |
B |
烧杯中的液体 |
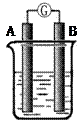 灵敏电流计指 灵敏电流计指针是否偏转 |
| 1 |
Zn |
Cu |
稀硫酸 |
有 |
| 2 |
Zn |
Cu |
乙醇 |
无 |
| 3 |
Cu |
C |
氯化钠溶液 |
有 |
| 4 |
Mg |
Al |
氢氧化钠溶液 |
有 |
分析上述数据,回答下列问题:
(1)实验1中电流由 极流向 极(填“A”或“B”)
(2)实验4中电子由B极 流向A极 ,表明负极是 电极(填“镁”或“铝”)
(3)实验3 表明
A.铜在潮湿空气中不会被腐蚀 B.铜的腐蚀是会发生的
(4)分析上表有关信息,下列说法不正确的是
A.相对活泼的金属一定做负极
B.失去电子的电极是负极
C.烧杯中的液体,必须是电解质溶液
D.浸入同一电解质溶液中的两个电极,是活泼性不同的两种金属(或其中一种非金属)
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图所示;两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电。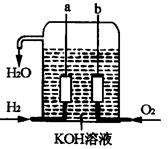
a极是 极,b极是 极,
负极反应式为: 。
化学能和电能的相互转化,是能量转化的重要方式之一,如图两个实验装置是实现化学能和电能相互转化的装置。
(1)把化学能转化为电能的装置是 (填“甲”或“乙”);
(2)④电极上的电极反应式为
(3)①电极上的电极反应式为 ,
检验该电极反应产物的方法是
(4)写出装置甲的反应总化学方程式 。
下表是50 mL稀硫酸与0.10 g某金属反应的实验数据:
| 实验 序号 |
金属 状态 |
c(H2SO4) /mol·L-1 |
溶液温度/℃ |
金属消失 的时间/s |
|
| 反应前 |
反应后 |
||||
| 1 |
丝 |
0.7 |
20 |
36 |
250 |
| 2 |
丝 |
0.8 |
20 |
35 |
200 |
| 3 |
粉末 |
0.8 |
20 |
35 |
25 |
| 4 |
丝 |
1.0 |
? |
35 |
125 |
| 5 |
丝 |
1.0 |
35 |
50 |
50 |
分析上述数据,回答下列问题:
(1)实验2和3表明, 对反应速率有影响, 反应速率越快;
(2) 实验4中“?”处的温度分别是 ℃。
(3) 仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号);
(4) 本实验中影响反应速率的其他因素还有 ,其实验序号是 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号