某探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如下表所示:
| 实验编号 |
锌的状态 |
反应温度/℃ |
收集100 mL氢气 所需时间/s |
| Ⅰ |
薄片 |
15 |
200 |
| Ⅱ |
薄片 |
25 |
90 |
| Ⅲ |
粉末 |
25 |
10 |
(1)该实验的目的是探究________、________对锌和稀盐酸反应速率的影响;
(2)实验Ⅰ和Ⅱ表明________,化学反应速率越大;
(3)能表明固体的表面积对反应速率有影响的实验编号是________和________;
(4)请设计一个实验方案证明盐酸的浓度对该反应的速率的影响:_______________________________________________________________。
某温度时,在2 L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:
(1)该反应的化学方程式为_________________________________________。
(2)反应开始至4 min时,A的平均反应速率为________________________________。
(3)4 min时,反应是否达到平衡状态?________(填“是”或“否”),8 min时,v(正)________v(逆)(填“>”、“<”或“=”)。
反应A+3B=2C+2D在四种不同情况下的反应速率可分别为
①v
| A.=0.15 mol/(L·s) ②v | B.=0.6 mol/(L·s) ③v | C.=0.4 mol/(L·s) ④v | D.=0.45 mol/(L·s) |
该反应进行的快慢顺序为________。
(10分)(1)可逆反应N2(g)+3H2(g) 2NH3(g)是一个放热反应,有甲乙两个完全相同的容器,向甲容器中加入1molN2和3molH2在一定条件下,达到平衡时放出的热量为Q1,相同条件下,向乙容器中加入2molNH3,达到平衡时,吸收的热量为Q2,已知Q2=4Q1,则甲容器中H2的转化率为 。
2NH3(g)是一个放热反应,有甲乙两个完全相同的容器,向甲容器中加入1molN2和3molH2在一定条件下,达到平衡时放出的热量为Q1,相同条件下,向乙容器中加入2molNH3,达到平衡时,吸收的热量为Q2,已知Q2=4Q1,则甲容器中H2的转化率为 。
(2)除电解法,工业炼镁还可采用硅热法(Pidgeon法)。即以煅白(CaO·MgO)为原料与硅铁(含硅75%的硅铁合金)混合置于密闭还原炉,1200℃下发生反应:
(CaO·MgO)(s) + Si(s) 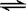 Ca2SiO4 (l) + 2Mg(g)
Ca2SiO4 (l) + 2Mg(g)
①已知还原性:Mg > Si,上述反应仍能发生的原因是______________________________
②由右图,推测上述反应正向为______(填“吸热”或“放热”)反应;平衡后若其他条件不变,将还原炉体积缩小一半,则达到新平衡时Mg(g)的浓度将______(填“升高” 、“降低”或“不变”)。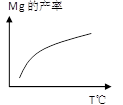
③若还原炉容积为400m3,原料中煅白质量为9.6 t,5小时后,测得煅白的转化率为50%,
计算这段时间Mg的生成速率 ___________ 。
(1)CCS技术是将工业和有关能源产业中所生产的CO2进行捕捉与封存的技术,被认为是拯救地球、应对全球气候变化最重要的手段之一。其中一种以天燃气为燃料的“燃烧前捕获系统”的简单流程图如图所示(部分条件及物 质未标出)。回答下列问题:
质未标出)。回答下列问题:
CH4在催化剂作用下实现第一步,也叫CH4不完全燃烧,1gCH4不完全燃烧反应放出2.21kJ热量,写出该反应的热化学方程式 。
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用(1)转化中得到的合成气制备甲醇。反应为CO(g)+2H2(g) CH3OH(g)某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见下图:
CH3OH(g)某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见下图:
①根据上图计算,从反应开始到tmin时,用H2浓度变化表示的平均反应速率v(H2)=
②t min至2tmin时速率变化的原因可能是 ;
③3tmin时对反应体系采取了一个措施,至4tmin时CO的物质的量为0.5mol,请完成上图CO的曲线。
(3)某同学按下图所示的装置用甲醇燃料电池(装置Ⅰ)进行电解的相关操作,以测定铜的相对原子质量,其中c电极为铜棒,d电极为石墨,X溶液为500mL0.4mol/L硫酸铜溶液。当装置Ⅱ中某电极上收集到标准状况下的气体V1mL时,另一电极增重mg(m<12.8)。
①装置Ⅰ中、H+向  极(填“a”或“b”)移动;b电极上发生的反应为 。
极(填“a”或“b”)移动;b电极上发生的反应为 。
②铜的相对原子质量的表 达式为 (用m和V1的代数式表示)。
达式为 (用m和V1的代数式表示)。
在某一化学反应中,反应物B的物质的量浓度在5 s内从2.0 mol·L-1变成
0.5 mol·L-1,在这5 s内B的化学反应速率为 。
某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法 收集反应放出的氢气,实验记录如下(累计值):
收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL) |
50 |
120 |
232 |
290 |
310 |
(1) 哪一时间段(填0~1、1~2、2~3、3~4、4~5 mi n)反应速率最大 ,原因是 。
n)反应速率最大 ,原因是 。
(2)哪一段时段的反应速率最小 ,原因是  (3)第2 ~ 3分钟时间段以盐酸的浓度表示的该反应速率(设溶液体积不变)是
(3)第2 ~ 3分钟时间段以盐酸的浓度表示的该反应速率(设溶液体积不变)是
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是
| A.蒸馏水 | B.NaCl溶液 | C.NaNO3溶液 |
| D.CuSO4溶液E.Na2CO3溶液F.CH3COONa溶液 |
Ⅰ.某探究小组用HNO3与大理石反应过程中固体质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K。请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 |
T/K |
大理石 质量/g |
规格 |
HNO3浓度/mol·L-1 |
HNO3 体积/ mL |
实验目的 |
| ① |
298 |
10.00 |
粗 |
1.00 |
25.00 |
(Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和 探究温度对该反应速率的影响; (Ⅲ)实验①和 探究大理石规格(粗、细)对该反应速率的影响。 |
Ⅱ.某种催化剂为铁的氧化物。化学兴趣小组在实验室对该催化剂中铁元素的价态进行探究:将适量稀硝酸加入少许样品中,加热溶解;取少许溶液,滴加KSCN溶液后出现红色。一位同学由此得出该催化剂中铁元素价态为+3的结论。
(1)请指出该结论是否合理,并说明理由 。
(2)请完成对铁元素价态的探究:
限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;3mol/L H2SO4、3%H2O2、6mol/L HNO3、0.01mol/L KMnO4、NaOH稀溶液、0.1mol/L KI、20%KSCN、蒸馏水。
① 提出合理假设
假设1: ;
假设2: ;
假设3: 。
② 基于上述假设,设计实验方案。请在答题卡上按下表格式写出实验操作步骤、预期现象与结论。
| 实验操作 |
预期现象与结论 |
| 步骤1 |
|
| 步骤2 |
|
| 步骤3 |
|
| …… |
|
向2L密闭容器中通入a mol气体A和b mol气体B,在一定条件下发生反应:
xA(g)+yB(g) pC(g)+qD(g) 已知:平均反应速率
pC(g)+qD(g) 已知:平均反应速率 ;反应2 min时A的浓度减少了a/6 mol/L,B的物质的量减少了
;反应2 min时A的浓度减少了a/6 mol/L,B的物质的量减少了 mol,有a mol D生成。
mol,有a mol D生成。
回答下列问题:
(1)反应2 min内,VA= ,vB=
(2)化学方程式中,x= y= p= q=
(3)反应达到平衡时,D为2a mol,则B的转化率为
(4)如果只升高反应温度,其他反应条件不变,平衡时D为1. 5a mol则该反应的
△H 0;(填“>、<或-”)
(5)如果其他条件不变,将容器的容积变为1L,进行同样的实验,则与上述反应比较:①反应速率 (填:“增大”“减小或“不变”)。理由是_
②平衡时反应物的转化率 (填:“增大”“减小”或“不变”)理由是
在T℃下,将1 mol N2和3 mol H2的混合气体通入固定体积为2L的密闭容器内,起始压强为101KPa,经过30s达到平衡,测得平衡混合气体的平均相对分子质量为10。试求:
此反应过程中N2的平均反应速率为_____________________________。
H2的转化率为_____________________。
维持一定温度和压强不变,在起始体积为2L的体积可变的容器中充入1 mol N2、3 mol H2,达平衡时N2的转化率与上述平衡相等,则该平衡时,容器的体积为_____________L。
化学反应速率可通过实验测定。要测定不同反应时刻反应物或生成物的浓度,可通过观察和测量体系中的某一物质的相关性质,再进行适当的转换和计算。如比较锌粒与不同浓度硫酸反应时的速率,可通过测定收集等体积H2需要的________来实现;在KMnO4与H2C2O4反应中,可通过观察单位时间内________________变化来测定该反应的速率;在Na2S2O3+H2SO4→Na2SO4+S↓+SO2↑+H2O反应中,该反应的速率可通过___ 来测定。
一密封体系中发生反应:N2 +3H2 2NH3 ΔH<0,
2NH3 ΔH<0,
①以下图1、图2均表示该反应在t1时达到平衡,在t2时改变某条件发生变化的曲线。
试判断,图1中t2时改变的条件是______________;图2中t2时改变的条件是____ _________。
②下图是某一时间段中反应速率与反应进程的曲线关系图:
下列各时间段时,氨的百分含量最高的是 。
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
③工业生产中提高合成氨反应的反应速率和产率的具体措施是:
A.降低温度 B. 增大压强 C. 降低压强
D. 循环利用和不断补充氮气 E. 及时移出氨气
在一体积固定的密闭容器中,某化学反应2A(g)  B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
| 实验 序号 |
  时 间 时 间浓度 温度 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
| 1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
800℃ |
c2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
800℃ |
c3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 4 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内,用A表示表示该反应的平均速率
为_ mol/(L . min)
(2)在实验2,A的初始浓度c2=____________mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是_______________________________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3_______v1
(填>、=、<),且c3_______1.0 mol/L(填>、=、<)。
(4)比较实验4和实验1,可推测该反应是________反应(选填吸热、放热)。
理由是___________________________________________________________
(5)根据以上实验请指出要加快该反应可采取什么样的方法(列举方法最少2种)
_________ __________________________________________________
下表是50 mL稀硫酸与0.10 g某金属反应的实验数据:
| 实验 序号 |
金属 状态 |
c(H2SO4) /mol·L-1 |
溶液温度/℃ |
金属消失 的时间/s |
|
| 反应前 |
反应后 |
||||
| 1 |
丝 |
0.7 |
20 |
36 |
250 |
| 2 |
丝 |
0.8 |
20 |
35 |
200 |
| 3 |
粉末 |
0.8 |
20 |
35 |
25 |
| 4 |
丝 |
1.0 |
? |
35 |
125 |
| 5 |
丝 |
1.0 |
35 |
50 |
50 |
分析上述数据,回答下列问题:
(1)实验2和3表明, 对反应速率有影响, 反应速率越快;
(2) 实验4中“?”处的温度分别是 ℃。
(3) 仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号);
(4) 本实验中影响反应速率的其他因素还有 ,其实验序号是 。
在锌与盐酸反应的实验中,一个学生得到的结果如下表所示:
| |
锌的质量/g |
锌的形状 |
温度/℃ |
完全溶于溶液的时间/s |
| A |
2 |
薄片 |
5 |
400 |
| B |
2 |
薄片 |
15 |
200 |
| C |
2 |
薄片 |
25 |
100 |
| D |
2 |
薄片 |
35 |
t1 |
| E |
2 |
细小颗粒 |
15 |
t2 |
| F |
2 |
粉末 |
15 |
t3 |
| G |
2 |
薄片(含少量杂质Cu) |
35 |
t4 |
(1)t1= s
(2)总结并得出的关于温度影响反应速率的结论是
(3)t1 t4(填“>”或“<”),原因是
t2 t3(填“>”或“<”),原因是
(4)单位时间内消耗锌的质量mB、mE、mF从大到小的顺序为