[广西]2011-2012年广西北海合浦县教育局教研室高二上学期期中考试化学(理)试卷
下列气体中,不会造成空气污染的是
| A.N2 | B.NO | C.NO2 | D.CO |
实验室制取下列气体时,与制氨气的发生装置相同的是
| A.H2 | B.O2 | C.Cl2 | D.CO2 |
在NO2与水的反应中,NO2
| A.只是氧化剂 | B.只是还原剂 |
| C.既是氧化剂,又是还原剂 | D.既不是氧化剂,又不是还原剂 |
硝酸应避光保存是因为它具有
| A.强酸性 | B.强氧化性 | C.挥发性 | D.不稳定性 |
加热下列各物质,发生氧化还原反应的是
| A.NH4Cl | B.NH4HCO3 | C.浓盐酸 | D.浓硝酸 |
某一反应物的物质的量浓度是1.0 mol·L-1,经过20 s后,它的浓度变成了0.2 mol·L-1,在这20 s内它的反应速率为
| A.0.04 | B.0.04 mol/(L.s) | C.0.8 mol/(L.s) | D.0.04 mol·L-1 |
在下列过程中,需要加快反应速率的是
| A.钢铁腐蚀 | B.食物腐败 | C.炼钢 | D.塑料老化 |
在一定条件下,对于密闭容器中进行的反应:P(g) + Q(g)  R(g) + S(g)。下列说法中可以充分说明这一反应已经达到化学平衡的是
R(g) + S(g)。下列说法中可以充分说明这一反应已经达到化学平衡的是
| A.P、Q、R、S的浓度相等 |
| B.P、Q、R、S在密闭容器共存 |
| C.P、Q、R、S的浓度不再变化 |
| D.用P来表示的反应速率与用Q表示的反应速率相等 |
在一定条件下,发生CO + NO2(红色) CO2 + N2的反应,达到化学平衡后,降低温度,混合物的颜色变浅,下列说法正确的是
CO2 + N2的反应,达到化学平衡后,降低温度,混合物的颜色变浅,下列说法正确的是
| A.正反应为吸热反应 | B.正反应为放热反应 |
| C.降温后CO的浓度增大 | D.降温后各物质的浓度不变 |
在通常情况下能共存,且均可用浓硫酸干燥的气体组是
| A.H2S、SO2 | B.NH3、CO2 | C.N2、CO2 | D.NO、O2 |
下列关于浓HNO3和浓H2SO4的叙述,正确的是
| A.都不易分解 |
| B.常温下都能与铜较快反应 |
| C.露置在空气中,容器内溶液的质量都减小 |
| D.露置在空气中,容器内溶液的浓度都减小 |
下列说法中正确的是
| A.非金属氧化物都是酸性氧化物 |
| B.金属氧化物都是碱性氧化物 |
| C.将氨转变成硝酸或其它氮的化合物称为固氮 |
| D.N2性质稳定,是因为N2分子中氮氮叁键键能很大 |
某硝酸盐R(NO3)2受热分解为RO、NO2和O2,将生成的气体充满一干燥烧瓶(标准状况)再将烧瓶倒置于水中,当液面不再上升时,烧瓶中溶质的物质的量浓度为
| A.0.8 mol/L | B.1/28 mol/L | C.1/14 mol/L | D.1/22.4mol/L |
下图曲线a表示放热反应 X (g) + 2Y (g)  Z (g) + M (g) 进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
Z (g) + M (g) 进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
| A.升高温度 |
| B.加大X的投入量 |
| C.加催化剂 |
| D.增大体积 |
在温度不变下,在恒压容器a与恒容容器b中,分别充入体积比为1∶3的N2和H2。若开始时两容器的体积相等,且在相同条件下达到平衡时,两容器中N2的转化率应当是
| A.a中大 | B.b中大 | C.a、b中一样大 | D.无法判断 |
以下叙述中不正确的是
| A.氮族元素是位于周期表中第ⅤA族元素 |
| B.氮族元素的最高正价与最低负价的绝对值之差等于2 |
| C.硝酸是一种不稳定的强酸,具有强氧化性 |
| D.王水是浓硝酸和浓盐酸(体积比3﹕1)的混合物 |
在一定温度下的固定容积的密闭容器中,当下列物理量不再变化时,表明反应:A (s)+2B (g)  C (g)+D (g) 已达平衡的是
C (g)+D (g) 已达平衡的是
| A.混合气体的压强 | B.混合气体的密度 |
C.混合气体的总质量 |
D.气体的总物质的量 |
有关合成氨的下列叙述中,不能用勒夏特列原理解释的是
| A.加入催化剂能使合成氨反应速率加快 | B.高压有利于提高NH3的产量 |
| C.温度过高不利于氨的生成 | D.增大N2浓度能提高H2的转化率 |
在常温常压下,向10mL 0.01mol/L FeCl3溶液中滴入1mL 0.01mol/L KSCN溶液,可发生反应FeCl3 + 3KSCN 3KCl + Fe(SCN)3,达到平衡后溶液显红色,能使平衡逆向移动的条件是
3KCl + Fe(SCN)3,达到平衡后溶液显红色,能使平衡逆向移动的条件是
| A.向溶液中加少量KCl晶体 | B.向溶液中加入少量水 |
| C.向溶液中滴入数滴 1mol/L FeCl3 | D.设法移走部分水 |
如图表示可逆反应mA(g) + nB(g)  pC(g)在不同温度(T)、压强(P)下,生成物C的物质的量分数x(C)的变化情况。下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是
pC(g)在不同温度(T)、压强(P)下,生成物C的物质的量分数x(C)的变化情况。下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是
A.吸热反应,m+n<p
B.吸热反应,m+n>p
C.放热反应,m+n<p
D.放热反应,m+n>p
氮族元素的最外层电子数为 ,随着核电荷数的递增,原子半径逐渐 ,得电子的能力逐渐 ,非金属性逐渐 ,其气态氢化物的稳定性逐渐 。
在某一化学反应中,反应物B的物质的量浓度在5 s内从2.0 mol·L-1变成
0.5 mol·L-1,在这5 s内B的化学反应速率为 。
在密闭容器中进行可逆反应:CO (g)+NO2 (g)  CO2 (g) + NO (g)(正反应为放热反应),达到平衡后,只改变其中一个条件,对平衡的影响是:(填“向左”、“向右”、“不移动”或颜色“变深”、“变浅”或“不变化”)
CO2 (g) + NO (g)(正反应为放热反应),达到平衡后,只改变其中一个条件,对平衡的影响是:(填“向左”、“向右”、“不移动”或颜色“变深”、“变浅”或“不变化”)
(1)增大容器的体积,平衡____________,反应混合物的颜色____________;
(2)通入CO2气体,平衡____________,反应混合物颜色_______________;
(3)升高温度,平衡_______________,反应混合物的颜色____________;
(4)加入一定量的N2,平衡____________,反应混合物的颜色___________;
(5)加入催化剂,平衡________________。
在一固定容积的密闭容器中,保持一定条件下进行以下反应:X(气)+2Y(气)  3Z(气)。已知加入1 molX和3molY。达到平衡后,生成a mol Z。
3Z(气)。已知加入1 molX和3molY。达到平衡后,生成a mol Z。
(1)在相同实验条件下,若在同一容器中改为加入2 mol X和6 mol Y,达到平衡后,Z的物质的量为 。
X和6 mol Y,达到平衡后,Z的物质的量为 。
(2)在相同实验条件下,若在同一容器中改为加入0.5molX,则需加入 mol Y,加入 mol Z,才能使平衡时Z为0.9 a mol。
X、Y、Z三种气体都是大气污染物,在工业上通常都用碱溶液吸。已知X是造成酸雨的主要物质;Y是一种单质,其水溶液具有漂白作用;Z是硝酸工业和汽车尾气中的有害物质之一,易溶于水。
(1)写出X、Y、Z的化学式:
X ; Y ; Z 。
(2)X能使湿润的红布条褪色,通过 方法能使布条颜色复原。
(3)写出下列有关反应的化学方程式:
X在一定条件下与氧气反应 。
Y与NaOH溶液反应 。
Z与水反应 。
实验室用下图所示装置,通过氯化铵固体与熟石灰固体反应来制取NH3,再和CuO反应制得N2,同时还原CuO得Cu。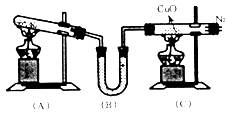
(1)写出(A)中反应的化学方程式:
(2)写出(C)中反应的化学方程式: ,在此反应中NH3表现出 性。
(3)装置(B)中装有 药品,作用是 。
(4)停止反应时,应先撤离 装置中的酒精灯。
(5)从(C)装置出来 的气体中可能含有 气体,若要获得较纯的N2,应采用 方法收集。
的气体中可能含有 气体,若要获得较纯的N2,应采用 方法收集。
 下反应:2A (g)+ B (g)
下反应:2A (g)+ B (g)  2C (g)。经60 s后反应达到平衡,此时容器内压强为起始时压强的0.8倍,试计算:
2C (g)。经60 s后反应达到平衡,此时容器内压强为起始时压强的0.8倍,试计算: 粤公网安备 44130202000953号
粤公网安备 44130202000953号