在500℃和催化剂存在的条件下,在固定容积的容器中发生如下反应2SO2(g)+O2(g) 2SO3(g)(正反应放热)。下列有关说法正确的是 ( )
2SO3(g)(正反应放热)。下列有关说法正确的是 ( )
| A.若降低温度,可以加快反应速率 | B.在上述条件下,SO2能完全转化为SO3 |
| C.使用催化剂是为了加快反应速率 | D.达到平衡时,SO2和SO3的浓度一定相等 |
在2A+B 3C+4D中,下列表示该反应速率最快的是
3C+4D中,下列表示该反应速率最快的是
| A.vA=0.5mol·L-1·s-1 | B.vB=0.3mol·L-1·s-1 |
| C.vC=0.8mol·L-1·s-1 | D.vD=1.0mol·L-1·s-1 |
把在空气中久置的铝片5.0 g投入盛有 500mL0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如右的坐标曲线来表示,回答下列问题:
(1)曲线由0→a段不产生氢气的原因___________,
有关反应的离子方程式为____________ ;
(2)曲线由a→b段产生氢气的速率较慢的原因___________
有关的化学方程式__________________________;
(3)曲线由b→c段,产生氢气的速率增加较快的主要原因_________________________;
(4)曲线由c以后,产生氢气的速率逐渐下降的主要原因_________________________。
将气体A、B置于容积为2L的密闭容器中,发生如下反应:4A(g)+B(g) 2C(g)。反应进行到4s末,测得A为0.5mol,B为0.4mol,C为0.2mol。用生成物C浓度的增大来表示该反应的速率为
2C(g)。反应进行到4s末,测得A为0.5mol,B为0.4mol,C为0.2mol。用生成物C浓度的增大来表示该反应的速率为
A.0.025mol·L-1·s-1 B.0.0125mol·L-1·s-1
C.0.05mol·L-1·s-1 D.0.1mol·L-1·s-1
在2A+B=3C+4D反应中,表示该反应速率最快的数据是
| A.vA="0.5" mol /(L·s) | B.vB=0.5mol/(L·s) |
| C.vC="0.8" mol /(L·s) | D.vD="30mol" /(L·min) |
设吸热反应C+CO2  2CO的反应速率为v1,放热反应N2+3H2
2CO的反应速率为v1,放热反应N2+3H2  2NH3的反应速率为v2,当温度升高时,v1和v2的变化情况为
2NH3的反应速率为v2,当温度升高时,v1和v2的变化情况为
| A.同时增大 | B.同时减小 | C.增大,减小 | D.减小,增大 |
用铁片与稀硫酸反应制取氢气时,下列措施能使氢气生成速率加大的是( )
| A.加少量CH3COONa固体 | B.加水 |
| C.不用铁片,改用铁粉 | D.不用稀硫酸,改用98%浓硫酸 |
运用相关化学知识进行判断,下列结论错误的是
| A.某吸热反应能自发进行,因此该反应是熵增反应 |
| B.NH4F 水溶液中含有 HF,因此 NH4F 溶液不能存放于玻璃试剂瓶中 |
| C.可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 |
| D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成 H2 的速率 |
使反应4NH3(g)+3O2(g)⇌2N2(g)+6H2O在2L的密闭容器中进行,半分钟后N2的物质的量增加了0.6mol.此反应的平均速率v(X)为
| A.v(NH3)="0.02" mol•L﹣1•s﹣1 | B.v(O2)="0.01" mol•L﹣1•s﹣1 |
| C.v(N2)="0.02" mol•L﹣1•s﹣1 | D.v(H2O)="0.02" mol•L﹣1•s﹣1 |
在2A(g)+B(g)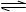 3C(g)+4D(g)反应中表示该反应速率最快的是 ( )
3C(g)+4D(g)反应中表示该反应速率最快的是 ( )
A.v(A)="0.5mol/(L·" s) B.v(B)="0.3mol/(L·" s)
C.v(C)="0.8mol/(L·" s) D.v(D)="1mol/(L·" s)
下列说法一定正确的是
A.反应A(s)  2B(g) + C(g),当C的体积分数不变时,反应达到平衡状态 2B(g) + C(g),当C的体积分数不变时,反应达到平衡状态 |
| B.将钢闸门与直流电源的正极相连,可防止钢闸门腐蚀 |
| C.用FeS为沉淀剂除去废水中的Hg2+:FeS(s)+ Hg2+(aq)=HgS(s)+Fe2+(aq) |
| D.增大反应物浓度可加快反应速率,因此可用浓硫酸与铁反应增大生成氢气的速率 |
在体积均为1.0L的恒容密闭容器中加入足量的相同的炭粉,再 分别加入0.1molCO2和
0.2molCO2,在不同温度下反应CO2(g)+C(s) 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )

| A.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) |
B.反应CO2(g)+C(s) 2CO(g)的△S>0、△H<0 2CO(g)的△S>0、△H<0 |
| C.体系的总压强P总:P总(状态Ⅱ)<2P总(状态Ⅰ) |
| D.逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
在一个容积不变的密闭容器中,发生反应:2NO(g)+O2(g) 2NO2(g)
2NO2(g)

(1)当n(NO):n(O2)=4:1时,O2的转化率随时间的变化关系如下图所示。
①A点的逆反应速率v逆 (O2)_____B点的正反应速率v正(O2)(填“大于”、“小于”或“等于” )。
②NO的平衡转化率为______;当达到B点后往容器中再以4:1 加入些
NO和 O2,当达到新平衡时,则NO的百分含量 B点NO的百分含量(填“大于”、“小于”或“等于” )。
③到达B点后,下列关系正确的是( )
| A.容器内气体颜色不再变化 |
| B.v正(NO)="2" v正(O2) |
| C.气体平均摩尔质量在此条件下达到最大 |
| D.容器内气体密度不再变化 |
(2)在下图1和图2中出现的所有物质都为气体,分析图1和图2,可推测:4NO(g)+3O2(g)=2N2O5(g)△H= 。


(3)降低温度,NO2(g)将转化为N2O4(g),以N2O4、O2、熔融NaNO3组成的燃料电池装置如右图所示,在使用过程中石墨I电极反应生成一种氧化物Y,Y为 ,有关石墨I电极反应式可表示为: 。
可逆反应2SO2(g)+O2(g) 2SO3(g),在不同条件下测得化学反应速率最快的为
2SO3(g),在不同条件下测得化学反应速率最快的为
| A.v(O2)=3 mol·L-1·min-1 |
| B.v (SO2) =4 mol·L-1·min-1 |
| C.v (SO3) =0.1 mol·L-1·s-1 |
| D.v (O2) =0.1 mol·L-1·s-1 |