在2A + B  3C + 4D中,表示该反应速率最快的是( )
3C + 4D中,表示该反应速率最快的是( )
A.υ(A) = 0.5mol•L-1•s-1 B.υ(B) = 0.2mol•L-1•s-1
C.υ(C) = 0.9mol•L-1•s-1 D.υ(D)=" 1" mol•L-1• s-1
在2A+B=3C+4D反应中,表示该反应速率最快的数据是 ( )
A.υ(A) = 0.5mol/(L·s) B.υ(B) = 0.3mol/(L·s)
C.υ(C) =" 0.8mol/(L·s) " D.υ(D) = 1.0mol/(L·s)
NH3和纯净的O2在一定条件下发生反应:4NH3(g)+3O2(g) 2N2(g)+6H2O(g),现向一容积不变的2 L密闭容器中充入4 mol NH3和3 mol O2,4 min后,测得生成的H2O占混合气体体积的40%,则下列表示此段时间内该反应的平均速率不正确的是
2N2(g)+6H2O(g),现向一容积不变的2 L密闭容器中充入4 mol NH3和3 mol O2,4 min后,测得生成的H2O占混合气体体积的40%,则下列表示此段时间内该反应的平均速率不正确的是
| A.v(O2)=0.225 mol·L-1·min-1 | B.v(H2O)=0.375 mol·L-1·min-1 |
| C.v(N2)=0.125 mol·L-1·min-1 | D.v(NH3)=0.250 mol·L-1·min-1 |
在2A+B  3C+4D反应中,表示该反应速率最快的是( )
3C+4D反应中,表示该反应速率最快的是( )
A.v(A)=0.5 mol·L-1·s-1 B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1 D.v(D)=0.6 mol·L-1·min-1
在2A(g)+ B(g)="3C(g)+" 4D(g)反应中,表示该反应速率最快的数据是
A.υ(A)= 0.6mol·L-1·s-1 B.υ(B)=" 0.2" mol·L-1·s-1
C.υ(C)=" 0.8" mol·L-1·s-1 D.υ(D)=" 1.0" mol·L-1·s-1
Ⅰ.可逆反应:A(g)+3B(g) 2C(g)+3D(g),取1 mol A和2 mol B置于2L容器内。1分钟后,测得容器内A的浓度为0.2 mol/L。
2C(g)+3D(g),取1 mol A和2 mol B置于2L容器内。1分钟后,测得容器内A的浓度为0.2 mol/L。
(1)这时B的浓度为________mol/L,C的浓度为________mol/L。
(2)这段时间内反应的平均速率若以D的浓度变化来表示,应为________mol/(L·min)。
(3)如果保持容器内温度不变,反应前和反应后容器内压强之比为_____(最简整数比)。
Ⅱ.电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液。请回答以下问题: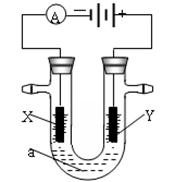
(4)在X极附近观察到的实验现象是:放出气体且______________。检验Y电极反应产物的方法是:把__________________放在Y电极附近,试纸变蓝色。
(5)当通过电解池通过1 mol电子时,两极共收集到________L气体(标准状况),电解池内的液体稀释到500 mL时,NaOH溶液浓度为________mol/L。
在2A+B  3C+5D反应中,表示该反应速率最快的是( )
3C+5D反应中,表示该反应速率最快的是( )
A、v (A)= 0.5 mol/(L·s) B、v (B)= 0.3 mol/(L·s)
C、v (C)= 0.8 mol/(L·s) D、v (D)= 1 mol/(L·s)
运用相关化学知识进行判断,下列结论错误的是
| A.某吸热反应能自发进行,因此该反应是熵增反应 |
| B.NH4F 水溶液中含有 HF,因此 NH4F 溶液不能存放于玻璃试剂瓶中 |
| C.可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 |
| D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成 H2 的速率 |
使反应4NH3(g)+3O2(g)⇌2N2(g)+6H2O在2L的密闭容器中进行,半分钟后N2的物质的量增加了0.6mol.此反应的平均速率v(X)为
| A.v(NH3)="0.02" mol•L﹣1•s﹣1 | B.v(O2)="0.01" mol•L﹣1•s﹣1 |
| C.v(N2)="0.02" mol•L﹣1•s﹣1 | D.v(H2O)="0.02" mol•L﹣1•s﹣1 |
在2A(g)+B(g)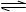 3C(g)+4D(g)反应中表示该反应速率最快的是 ( )
3C(g)+4D(g)反应中表示该反应速率最快的是 ( )
A.v(A)="0.5mol/(L·" s) B.v(B)="0.3mol/(L·" s)
C.v(C)="0.8mol/(L·" s) D.v(D)="1mol/(L·" s)
下列说法一定正确的是
A.反应A(s)  2B(g) + C(g),当C的体积分数不变时,反应达到平衡状态 2B(g) + C(g),当C的体积分数不变时,反应达到平衡状态 |
| B.将钢闸门与直流电源的正极相连,可防止钢闸门腐蚀 |
| C.用FeS为沉淀剂除去废水中的Hg2+:FeS(s)+ Hg2+(aq)=HgS(s)+Fe2+(aq) |
| D.增大反应物浓度可加快反应速率,因此可用浓硫酸与铁反应增大生成氢气的速率 |
在体积均为1.0L的恒容密闭容器中加入足量的相同的炭粉,再 分别加入0.1molCO2和
0.2molCO2,在不同温度下反应CO2(g)+C(s) 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )

| A.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) |
B.反应CO2(g)+C(s) 2CO(g)的△S>0、△H<0 2CO(g)的△S>0、△H<0 |
| C.体系的总压强P总:P总(状态Ⅱ)<2P总(状态Ⅰ) |
| D.逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
在一个容积不变的密闭容器中,发生反应:2NO(g)+O2(g) 2NO2(g)
2NO2(g)

(1)当n(NO):n(O2)=4:1时,O2的转化率随时间的变化关系如下图所示。
①A点的逆反应速率v逆 (O2)_____B点的正反应速率v正(O2)(填“大于”、“小于”或“等于” )。
②NO的平衡转化率为______;当达到B点后往容器中再以4:1 加入些
NO和 O2,当达到新平衡时,则NO的百分含量 B点NO的百分含量(填“大于”、“小于”或“等于” )。
③到达B点后,下列关系正确的是( )
| A.容器内气体颜色不再变化 |
| B.v正(NO)="2" v正(O2) |
| C.气体平均摩尔质量在此条件下达到最大 |
| D.容器内气体密度不再变化 |
(2)在下图1和图2中出现的所有物质都为气体,分析图1和图2,可推测:4NO(g)+3O2(g)=2N2O5(g)△H= 。


(3)降低温度,NO2(g)将转化为N2O4(g),以N2O4、O2、熔融NaNO3组成的燃料电池装置如右图所示,在使用过程中石墨I电极反应生成一种氧化物Y,Y为 ,有关石墨I电极反应式可表示为: 。
可逆反应2SO2(g)+O2(g) 2SO3(g),在不同条件下测得化学反应速率最快的为
2SO3(g),在不同条件下测得化学反应速率最快的为
| A.v(O2)=3 mol·L-1·min-1 |
| B.v (SO2) =4 mol·L-1·min-1 |
| C.v (SO3) =0.1 mol·L-1·s-1 |
| D.v (O2) =0.1 mol·L-1·s-1 |