已知:4NH3+5O2=4NO+6H2O,若反应速率分别用ν(NH3)、ν(O2)、ν(NO)、ν(H2O)表示,则正确的关系是
| A.5ν(NH3)=4ν(O2) | B.5ν(O2)=6ν(H2O) |
| C.2ν(NH3)=3ν(H2O) | D.5ν(O2)=4ν(NO) |
对于反应2SO2(g) +O2(g) 2SO3(g),能增大正反应速率的措施是
2SO3(g),能增大正反应速率的措施是
| A.通入大量O2 | B.增大反应容器容积 |
| C.移去部分SO3 | D.降低体系温度 |
反应4A(g)+5B(s)═4C(g)+6D(g)在0.5L密闭容器中进行,30s内A减少了0.90mol,则此反应的速率可表示为
A.v(B)=0.075mol/(L•s) B.v(A)=0.030mol/(L•s)
C.v(C)=0.040mol/(L•s) D.v(D)=0.090mol/(L•s)
节能减排是中国转型发展的必经之路,工业生产中联合生产是实现节能减排的重要措施,下图是几种工业生产的联合生产工艺:
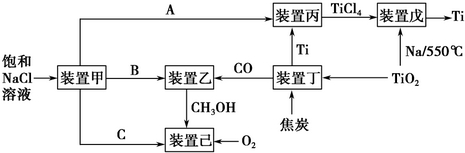
请回答下列问题:
(1)装置甲为电解池(惰性电极),根据图示转化关系可知:A为__________(填化学式),阴极反应式为__________。
(2)装置丙的反应物为Ti,而装置戊的生成物为Ti,这两个装置在该联合生产中并不矛盾,原因是__________装置戊进行反应时需要的环境为__________(填字母序号).
A.HCl气体氛围中 B.空气氛围中 C.氩气氛围中 D.水中
(3)装置乙中发生的是工业合成甲醇的反应:CO(g)+2H2(g)=CH3OH(g)△H<0.
①该反应在不同温度下的化学平衡常数(K)如下表:
| 温度/℃ |
250 |
350 |
| K |
2.041 |
x |
符合表中的平衡常数x的数值是__________(填字母序号).
A.0 B.0.012 C.32.081 D.100
②若装置乙为容积固定的密闭容器,不同时间段各物质的浓度如下表:
| |
c(CO)/mol•L-1 |
c(H2)/mol•L-1 |
c(CH3OH)/mol•L-1 |
| 0min |
0.8mol•L-1 |
1.6mol•L-1 |
0 |
| 2min |
0.6mol•L-1 |
y |
0.2mol•L-1 |
| 4min |
0.3mol•L-1 |
0.6mol•L-1 |
0.5mol•L-1 |
| 6min |
0.3mol•L-1 |
0.6mol•L-1 |
0.5mol•L-1 |
反应从2min到4min之间,H2的平均反应速率为__________,反应达到平衡时CO的转化率为__________,反应在第2min时改变了反应条件,改变的条件可能是__________(填字母序号).
A.使用催化剂 B.降低温度 C.增加H2的浓度
一定温度下,反应N2(g)+O2(g)  2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是
2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是
| A.缩小体积 | B.恒容,充入He | C.恒容,充入O2 | D.恒压,充入N2 |
已知4NH3(g)+5O2(g)=4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列关系正确的是( )
| A.4 v(NH3)="5" v(O2) | B.5v(O2)="6" v(H2O) |
| C.2 v(NH3)="3" v(H2O) | D.4v(O2)=" 5" v(NO) |
如图是表示:2X(g)+Y(g)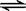 Z(g)+R(s)+Q(g)的气体反应速率(υ)与时间(t)的关系,
Z(g)+R(s)+Q(g)的气体反应速率(υ)与时间(t)的关系,
t1时开始改变条件,则所改变的条件符合曲线的是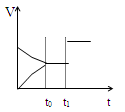
| A.减少Z物质 | B.使用催化剂 | C.升高温度 | D.加大压强 |
已知:2X(g)+ Y(g) a Z(g),在T1温度下,体积为2L的密闭容器中,充入6mol X和2mol Y。根据图示回答:
a Z(g),在T1温度下,体积为2L的密闭容器中,充入6mol X和2mol Y。根据图示回答:

(1)a =________;用Y的浓度变化表示从反应开始到平衡时的平均反应速率为___________mol/(L•min)。
(2)平衡时,Y在混合物中的物质的量分数是___________。
(3)其他条件不变时,下列措施可以提高Y的转化率的是___________(选填字母)。
A.使用适当的催化剂 B.分离出Z C.增大容器体积
某探究小组同学用金属铝分别与稀盐酸或稀硫酸反应的方法研究金属与不同酸反应的差异及影响反应速率的因素.
实验药品:2.0moL/L盐酸、4.0mol/L盐酸、2.0mol/L硫酸、4.0mol/L硫酸,质量和相同的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为50.0mL,金属用量均为9.0g.
(Ⅰ)甲同学用铝片分别和稀盐酸、稀硫酸反应,实验及其现象如下:
| 反应进程(分钟) |
1 |
2 |
5 |
15 |
20 |
| 4.0mol/L盐酸 |
少量气泡 |
较多气泡 |
大量气泡 |
反应剧烈 |
反应结束 |
| 2.0mol/L硫酸 |
无明显现象 |
极少量气泡 |
少量气泡 |
||
| 4.0mol/L硫酸 |
无明显现象 |
少量气泡 |
有比较连续的气泡 |
请回答:
(1)写出铝与盐酸反应的离子方程式 .
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,其原因是 .
(3)以上探究铝与稀盐酸、稀硫酸反应速率有差异,你认为其原因有哪些可能?请提出你的假设(写出2种可能):
(Ⅱ)(1)乙同学设计了如下影响反应速率因素的实验(温度控制为25℃和35℃).请你根据实验目的帮助该同学完成以下实验设计表(用量:酸均为50.0mL、铝为9.0g过量):
| 实验目的 |
实验 编号 |
温度 |
金属铝 形态 |
盐酸浓度 /mol·L﹣1 |
| 1 实验①和②探究盐酸浓度对该反应速率的影响; 2实验①和③探究温度对该反应速率的影响; 3实验①和④探究金属规格(铝片、铝粉)对该反应速率的影响. |
① |
25˚C |
铝片 |
4.0 |
| ② |
|
|
|
|
| ③ |
|
|
|
|
| ④ |
|
|
|
运用相关化学知识进行判断,下列结论错误的是
| A.某吸热反应能自发进行,因此该反应是熵增反应 |
| B.NH4F 水溶液中含有 HF,因此 NH4F 溶液不能存放于玻璃试剂瓶中 |
| C.可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 |
| D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成 H2 的速率 |
设吸热反应C+CO2  2CO的反应速率为v1,放热反应N2+3H2
2CO的反应速率为v1,放热反应N2+3H2  2NH3的反应速率为v2,当温度升高时,v1和v2的变化情况为
2NH3的反应速率为v2,当温度升高时,v1和v2的变化情况为
| A.同时增大 | B.同时减小 | C.增大,减小 | D.减小,增大 |
使反应4NH3(g)+3O2(g)⇌2N2(g)+6H2O在2L的密闭容器中进行,半分钟后N2的物质的量增加了0.6mol.此反应的平均速率v(X)为
| A.v(NH3)="0.02" mol•L﹣1•s﹣1 | B.v(O2)="0.01" mol•L﹣1•s﹣1 |
| C.v(N2)="0.02" mol•L﹣1•s﹣1 | D.v(H2O)="0.02" mol•L﹣1•s﹣1 |
在2A(g)+B(g)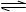 3C(g)+4D(g)反应中表示该反应速率最快的是 ( )
3C(g)+4D(g)反应中表示该反应速率最快的是 ( )
A.v(A)="0.5mol/(L·" s) B.v(B)="0.3mol/(L·" s)
C.v(C)="0.8mol/(L·" s) D.v(D)="1mol/(L·" s)