对反应 A+3B  2C 来说,下列反应速率中,最快的是
2C 来说,下列反应速率中,最快的是
A.v(A)=0.3 mol/(L·min) B.v(B)=0.6 mol/(L·min)
C.v(C)=0.5 mol/(L·min) D.v(A)=0.1 mol/(L·s)
氢离子浓度相同的等体积的两份溶液A和B;A为盐酸,B为醋酸,分别和锌反应,若最后仅有一份溶液中存在锌,且放出氢气的质量相同,则下列说法正确的是( )
①反应所需要的时间B>A ②开始反应时的速率A>B ③参加反应的锌的物质的量A=B ④反应过程的平均速率B>A ⑤盐酸里有锌剩余 ⑥醋酸里有锌剩余
| A.③④⑤ | B.③④⑥ | C.②③⑤ | D.②③⑤⑥ |
一定条件下存在反应:CO(g)+H2O(g) CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器I、II、III,在I中充入1 mol CO和1 mol H2O,在II中充入1 mol CO2和1 mol H2,在III中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是( )
CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器I、II、III,在I中充入1 mol CO和1 mol H2O,在II中充入1 mol CO2和1 mol H2,在III中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是( )
| A.容器I、II中正反应速率相同 |
| B.容器I、III中反应的平衡常数相同 |
| C.容器I中CO 的物质的量比容器II中的少 |
| D.容器I中CO 的转化率与容器II中CO2的转化率之和小于1 |
在锌与盐酸反应的实验中,一个学生得到的结果如下表所示:
| |
锌的质量/g |
锌的形状 |
温度/℃ |
完全溶于溶液的时间/s |
| A |
2 |
薄片 |
5 |
400 |
| B |
2 |
薄片 |
15 |
200 |
| C |
2 |
薄片 |
25 |
100 |
| D |
2 |
薄片 |
35 |
t1 |
| E |
2 |
细小颗粒 |
15 |
t2 |
| F |
2 |
粉末 |
15 |
t3 |
| G |
2 |
薄片(含少量杂质Cu) |
35 |
t4 |
(1)t1= s
(2)总结并得出的关于温度影响反应速率的结论是
(3)t1 t4(填“>”或“<”),原因是
t2 t3(填“>”或“<”),原因是
(4)单位时间内消耗锌的质量mB、mE、mF从大到小的顺序为
下列有关化学反应速率的说法中,正确的是
| A.100 mL 2 mol/L盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 |
B.对于可逆反应2CO + 2NO  N2 + 2CO2,使用合适的催化剂,CO的生成速率和消耗速率都加快 N2 + 2CO2,使用合适的催化剂,CO的生成速率和消耗速率都加快 |
| C.二氧化硫的催化氧化是一个放热反应,升高温度,正反应速率减慢 |
| D.用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快氢气的产生 |
如图为某化学反应的速率与时间的关系示意图。在t1时刻升高温度或增大压
强,速率的变化都符合示意图的反应是 ( )
A.2SO2(g)+O2(g) 2SO3(g);ΔH<0 2SO3(g);ΔH<0 |
|
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g);ΔH<0 4NO(g)+6H2O(g);ΔH<0 |
|
C.H2(g)+I2(g) 2HI(g);ΔH>0 2HI(g);ΔH>0 |
D.2A(g)+B(g) 2C(g);ΔH>0 2C(g);ΔH>0 |
已知反应A+3B 2C+D,在某段时间内以A的浓度变化表示的化学反应速率为1mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为
2C+D,在某段时间内以A的浓度变化表示的化学反应速率为1mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为
| A.0.5mol·L-1·min-1 | B.1mol·L-1·min-1 |
| C.2mol·L-1·min-1 | D.3mol·L-1·min-1 |
运用相关化学知识进行判断,下列结论错误的是
| A.某吸热反应能自发进行,因此该反应是熵增反应 |
| B.NH4F 水溶液中含有 HF,因此 NH4F 溶液不能存放于玻璃试剂瓶中 |
| C.可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 |
| D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成 H2 的速率 |
使反应4NH3(g)+3O2(g)⇌2N2(g)+6H2O在2L的密闭容器中进行,半分钟后N2的物质的量增加了0.6mol.此反应的平均速率v(X)为
| A.v(NH3)="0.02" mol•L﹣1•s﹣1 | B.v(O2)="0.01" mol•L﹣1•s﹣1 |
| C.v(N2)="0.02" mol•L﹣1•s﹣1 | D.v(H2O)="0.02" mol•L﹣1•s﹣1 |
在2A(g)+B(g)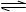 3C(g)+4D(g)反应中表示该反应速率最快的是 ( )
3C(g)+4D(g)反应中表示该反应速率最快的是 ( )
A.v(A)="0.5mol/(L·" s) B.v(B)="0.3mol/(L·" s)
C.v(C)="0.8mol/(L·" s) D.v(D)="1mol/(L·" s)
下列说法一定正确的是
A.反应A(s)  2B(g) + C(g),当C的体积分数不变时,反应达到平衡状态 2B(g) + C(g),当C的体积分数不变时,反应达到平衡状态 |
| B.将钢闸门与直流电源的正极相连,可防止钢闸门腐蚀 |
| C.用FeS为沉淀剂除去废水中的Hg2+:FeS(s)+ Hg2+(aq)=HgS(s)+Fe2+(aq) |
| D.增大反应物浓度可加快反应速率,因此可用浓硫酸与铁反应增大生成氢气的速率 |
在体积均为1.0L的恒容密闭容器中加入足量的相同的炭粉,再 分别加入0.1molCO2和
0.2molCO2,在不同温度下反应CO2(g)+C(s) 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )

| A.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) |
B.反应CO2(g)+C(s) 2CO(g)的△S>0、△H<0 2CO(g)的△S>0、△H<0 |
| C.体系的总压强P总:P总(状态Ⅱ)<2P总(状态Ⅰ) |
| D.逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
在一个容积不变的密闭容器中,发生反应:2NO(g)+O2(g) 2NO2(g)
2NO2(g)

(1)当n(NO):n(O2)=4:1时,O2的转化率随时间的变化关系如下图所示。
①A点的逆反应速率v逆 (O2)_____B点的正反应速率v正(O2)(填“大于”、“小于”或“等于” )。
②NO的平衡转化率为______;当达到B点后往容器中再以4:1 加入些
NO和 O2,当达到新平衡时,则NO的百分含量 B点NO的百分含量(填“大于”、“小于”或“等于” )。
③到达B点后,下列关系正确的是( )
| A.容器内气体颜色不再变化 |
| B.v正(NO)="2" v正(O2) |
| C.气体平均摩尔质量在此条件下达到最大 |
| D.容器内气体密度不再变化 |
(2)在下图1和图2中出现的所有物质都为气体,分析图1和图2,可推测:4NO(g)+3O2(g)=2N2O5(g)△H= 。


(3)降低温度,NO2(g)将转化为N2O4(g),以N2O4、O2、熔融NaNO3组成的燃料电池装置如右图所示,在使用过程中石墨I电极反应生成一种氧化物Y,Y为 ,有关石墨I电极反应式可表示为: 。
可逆反应2SO2(g)+O2(g) 2SO3(g),在不同条件下测得化学反应速率最快的为
2SO3(g),在不同条件下测得化学反应速率最快的为
| A.v(O2)=3 mol·L-1·min-1 |
| B.v (SO2) =4 mol·L-1·min-1 |
| C.v (SO3) =0.1 mol·L-1·s-1 |
| D.v (O2) =0.1 mol·L-1·s-1 |