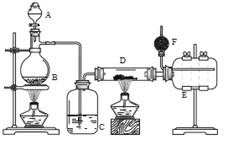
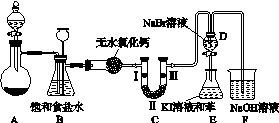
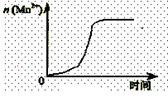
把在空气中久置的铝片5.0 g投入盛有 500mL0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如右的坐标曲线来表示,回答下列问题:
(1)曲线由0→a段不产生氢气的原因___________,
有关反应的离子方程式为____________ ;
(2)曲线由a→b段产生氢气的速率较慢的原因___________
有关的化学方程式__________________________;
(3)曲线由b→c段,产生氢气的速率增加较快的主要原因_________________________;
(4)曲线由c以后,产生氢气的速率逐渐下降的主要原因_________________________。
粤ICP备20024846号
 粤公网安备 44130202000953号
粤公网安备 44130202000953号
 粤公网安备 44130202000953号
粤公网安备 44130202000953号
Copyright ©2020-2024 优题课 youtike.com 版权所有
Powered by:Youtike Platform 6.6.3
声明:本网站部分内容由互联网用户自发贡献自行上传,本网站不拥有所有权,也不承担相关法律责任。
如果您发现有涉嫌版权的内容,欢迎发送邮件至:service@youtike.com 或 联系QQ:267757 进行举报,一经查实,本站将立刻删除涉嫌侵权内容。
如果您发现有涉嫌版权的内容,欢迎发送邮件至:service@youtike.com 或 联系QQ:267757 进行举报,一经查实,本站将立刻删除涉嫌侵权内容。
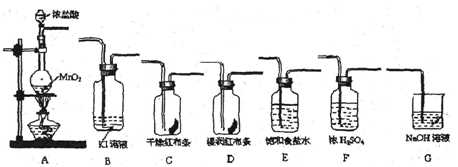
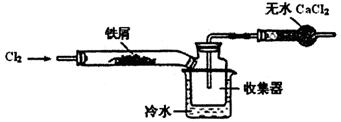
 NaClO3+3H2
NaClO3+3H2 ,2NaClO3+4HCl=2C1O2
,2NaClO3+4HCl=2C1O2