Ⅰ.无水氯化铝是有机化工常用催化剂,其外观为白色固体,178℃时升华,极易潮解,遇水后会发热并产生白雾。实验室用如下装置制备少量无水氯化铝,其反应原理为:2Al + 6HCl(g) = 2AlCl3 + 3H2
完成下列填空: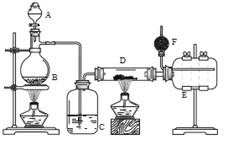
A为浓硫酸,B为NaCl固体
(1)进行实验时应先点燃 (选填“B”或“D”)处酒精灯。
(2)用粗短导管连接D、E的目的是________(选填序号)。
a.防堵塞 b.防倒吸 c.平衡气压 d.冷凝回流
(3)F中盛有碱石灰,其目的是 (选填序号)。
a.吸收多余HCl b.吸收Cl2
c.吸收CO2 d.防止空气中H2O进入E瓶
(4)将D中固体改为氯化铝晶体(AlCl3·6H2O)也能进行无水氯化铝的制备,此时通入HCl气体的目的是 。若实验条件控制不当,最终得到的物质是碱式氯化铝[化学式为Al2(OH)nCl(6-n)],且质量是原氯化铝晶体(AlCl3·6H2O)的40%,则可推算n的值为 。
Ⅱ.焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。Na2S2O5溶于水即生成NaHSO3。
(1)证明NaHSO3溶液中HSO3—的电离程度大于水解程度,可采用的实验方法是 (填序号)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
(2)检验Na2S2O5晶体在空气中已被氧化的实验方案是________ ______。
(3)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量的方案如下:
(已知:滴定时反应的化学方程式为SO2 + I2 + 2 H2O = H2SO4 + 2 HI)
按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 g/L。在上述实验过程中,若有部分HI被空气氧化,则测得结果 (填“偏高”、“偏低”或“不变”)。




 [实验探究]丙同学为了检验H2,收集了一试管气体,用拇指堵住试管口且管口略向下倾斜靠近火焰移开拇指点火,听到很小的声音。然后再将气体用带尖嘴的导管导出点燃且用冷而干燥的烧杯罩在火焰上方,气体在空气中安静的燃烧,产生淡蓝色火焰,烧杯壁上有水珠生成,接触烧杯的手能感觉到发热。 结论:铁粉与硫酸铜的溶液反应时,产生的气体是 。
[实验探究]丙同学为了检验H2,收集了一试管气体,用拇指堵住试管口且管口略向下倾斜靠近火焰移开拇指点火,听到很小的声音。然后再将气体用带尖嘴的导管导出点燃且用冷而干燥的烧杯罩在火焰上方,气体在空气中安静的燃烧,产生淡蓝色火焰,烧杯壁上有水珠生成,接触烧杯的手能感觉到发热。 结论:铁粉与硫酸铜的溶液反应时,产生的气体是 。 粤公网安备 44130202000953号
粤公网安备 44130202000953号