将一定量的SO2和氧气放入一定体积的密容器中,550℃时在催化剂作用下发生反应:2SO2(g)+2O2 (g) 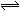 2SO3(g) (正反应放热)。下列能判断该反应达到平衡状态的标志是
2SO3(g) (正反应放热)。下列能判断该反应达到平衡状态的标志是
| A.容器中混合气体的密度保持不变 | B.每消耗1molO2的同时生成1molSO3 |
| C.容器中气体的压强不变 | D.SO3的生成速率与SO2的消耗速率相等 |
向容积为2 L的密闭容器中充入2 mol A气体和1 mol B气体,在一定条件下发生如下反应:2A(g)+B(g) 3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
① 用物质A表示该反应的平均反应速率为0.2 mol·L-1·s-1
② 用物质B表示该反应的平均反应速率为0.2 mol·L-1·s-1
③ 平衡时物质A与B的转化率相等
④ 平衡时物质B的浓度为0.2 mol·L-1
| A.①②③ | B.①③ | C.②④ | D.①③④ |
在恒温、体积为2L的密闭容器中进行反应:2A(g)  3B(g)+C(g),若反应物在前20s由3mol降为1.8mol,则前20s的平均反应速度为
3B(g)+C(g),若反应物在前20s由3mol降为1.8mol,则前20s的平均反应速度为
A、v(B)="0.03mol/(L·s) " B、v(B)="0.045mol/(L·s) "
C、v(C)="0.03mol/(L·s) " D、v(C)=0.06mol/(L·s)
下列说法中正确的是
| A.已知:2H2O(l)= 2H2(g)+O2(g);△H1>0 H2O(l)=H2(g)+1/2 O2(g);△H2>0则△H1>△H2 |
| B.在合成氨工业生产中,为提高氢气的转化率,可采取使用催化剂的措施 |
| C.因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N |
| D.热量可能自发地从低温物体传递到高温物体 |
下图表示反应N2(g)+3H2(g) ="=" 2NH3 (g);△H﹤0在某一时间段中反应速率与反应过程的曲线关系图。下列说法正确的是
| A.氨气的体积分数最高的一段时间为t5—t6 |
| B.t2—t3和t3—t4时间段氨气的体积分数相等 |
| C.t1时刻改变的条件是降低温度 |
| D.t4—t5时间段平衡向正反应方向移动 |
已知:(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) △H="74.9" kJ·mol-1,下列说法中正确的是
| A.该反应中熵变、焓变皆大于0 |
| B.该反应是吸热反应,因此一定不能自发进行 |
| C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行 |
| D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应 |
对于某一化学反应,下列各项反应条件改变,能使反应历程改变,降低化学反应的活化能,从而提高反应速率的是 ( )
| A.增大反应物浓度 | B.加压 |
| C.加催化剂 | D.升温 |
下表是50 mL稀硫酸与0.10 g某金属反应的实验数据:
| 实验 序号 |
金属 状态 |
c(H2SO4) /mol·L-1 |
溶液温度/℃ |
金属消失 的时间/s |
|
| 反应前 |
反应后 |
||||
| 1 |
丝 |
0.7 |
20 |
36 |
250 |
| 2 |
丝 |
0.8 |
20 |
35 |
200 |
| 3 |
粉末 |
0.8 |
20 |
35 |
25 |
| 4 |
丝 |
1.0 |
? |
35 |
125 |
| 5 |
丝 |
1.0 |
35 |
50 |
50 |
分析上述数据,回答下列问题:
(1)实验2和3表明, 对反应速率有影响, 反应速率越快;
(2) 实验4中“?”处的温度分别是 ℃。
(3) 仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号);
(4) 本实验中影响反应速率的其他因素还有 ,其实验序号是 。
下列叙述正确的是( )
| A.物质燃烧不一定是放热反应 |
| B.放热反应不需要从外界吸收任何能量就能发生 |
| C.在一个确定的化学反应中,反应物总能量总是高于生成物总能量 |
| D.放在冰箱中的食品保质期较长,这与温度对反应速率的影响有关 |
氢离子浓度相同的等体积的两份溶液A和B;A为盐酸,B为醋酸,分别和锌反应,若最后仅有一份溶液中存在锌,且放出氢气的质量相同,则下列说法正确的是( )
①反应所需要的时间B>A ②开始反应时的速率A>B ③参加反应的锌的物质的量A=B ④反应过程的平均速率B>A ⑤盐酸里有锌剩余 ⑥醋酸里有锌剩余
| A.③④⑤ | B.③④⑥ | C.②③⑤ | D.②③⑤⑥ |
将气体A、B置于容积为2 L的密闭容器中,发生如下反应:
4A(g)十B(g)=2C(g)
反应进行到4 s末,测得A为0.5 mol,B为0.4 mol,C为0.2 mol。则用反应物A浓度的减少来表示该反应的速率应为( )
A. 0.025 mol/(L·s) B. 0.012 5 mol/(L·s)
C. 0.05 mol/(L·s) D. 0.1 mol/(L·s)
在锌与盐酸反应的实验中,一个学生得到的结果如下表所示:
| |
锌的质量/g |
锌的形状 |
温度/℃ |
完全溶于溶液的时间/s |
| A |
2 |
薄片 |
5 |
400 |
| B |
2 |
薄片 |
15 |
200 |
| C |
2 |
薄片 |
25 |
100 |
| D |
2 |
薄片 |
35 |
t1 |
| E |
2 |
细小颗粒 |
15 |
t2 |
| F |
2 |
粉末 |
15 |
t3 |
| G |
2 |
薄片(含少量杂质Cu) |
35 |
t4 |
(1)t1= s
(2)总结并得出的关于温度影响反应速率的结论是
(3)t1 t4(填“>”或“<”),原因是
t2 t3(填“>”或“<”),原因是
(4)单位时间内消耗锌的质量mB、mE、mF从大到小的顺序为
在2L的密闭容器中发生下面反应:A(g)+2B(g)=3C(g),经过3min后A的物质由10mol变为7mol,则下面表示的反应速率正确的是
| A.vA=1mol·L-1·min-1 | B.vB=1mol·L-1·min-1 |
| C.vC=2mol·L-1·min-1 | D.vB=2mol·L-1·min-1 |
如图为某化学反应的速率与时间的关系示意图。在t1时刻升高温度或增大压
强,速率的变化都符合示意图的反应是 ( )
A.2SO2(g)+O2(g) 2SO3(g);ΔH<0 2SO3(g);ΔH<0 |
|
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g);ΔH<0 4NO(g)+6H2O(g);ΔH<0 |
|
C.H2(g)+I2(g) 2HI(g);ΔH>0 2HI(g);ΔH>0 |
D.2A(g)+B(g) 2C(g);ΔH>0 2C(g);ΔH>0 |
等物质的量A、B、C、D四种物质混合,发生如下反应:
aA(?)+bB(?) cC(固)+dD(?)
cC(固)+dD(?)
当反应进行到一定时间后,测得A减少n mol,B减少 ,C增加
,C增加 ,
,
D增加n mol,此时达到化学平衡状态.
(1)该化学方程式中各系数为a=________,b=________,c=________,d=________.
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,则该反应中各物质的聚集状态是:A_________,B_________,D_________.
(3)若只升高温度,反应一段时间后,测知四种物质的量又达到相等,则该反应是________反应(填“放热”或“吸热”