设NA为阿伏伽德罗常数的值。下列说正确的是
| A.高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA |
| B.室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA |
| C.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA |
D.5NH4NO3 2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA 2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA |
(本题共14分)已知:硝酸铜受热易分解。
170℃时,2Cu (NO3)2 2CuO
2CuO 4NO2↑
4NO2↑ O2↑开始分解,至250℃分解完全。(其中2NO2
O2↑开始分解,至250℃分解完全。(其中2NO2 N2O4,2NO2
N2O4,2NO2 2NO
2NO O2等反应忽略不计)。
O2等反应忽略不计)。
800℃时,4CuO 2Cu2O
2Cu2O O2↑ 开始分解,至1000℃以上分解完全。
O2↑ 开始分解,至1000℃以上分解完全。
54.取5.64g无水硝酸铜,加热至1000℃以上,将生成的气体导入足量的NaOH溶液充分吸收后,还有逸出的气体是 (填分子式),体积(标准状况)为 ;将吸收液加水稀释到100mL,此溶液中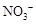 的物质的量浓度为 。
的物质的量浓度为 。
55.取5.64g无水硝酸铜加热至某温度分解后的残留固体中含有1.60g CuO,则残留固体的质量可能是 。
实验证明,当温度达到1800℃时,Cu2O也会发生分解:2Cu2O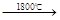 4Cu
4Cu O2↑
O2↑
56.取8.00g CuO,加热到1800℃左右,冷却后称得质量为6.88g,通过计算求出反应后剩余固体中各成分的物质的量之比。
57.取8.00g CuO,通入一定量H2并加热,使其部分还原为Cu和Cu2O,且其中n (Cu2O) n (Cu)
n (Cu)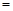 x。将此混合物溶于足量的稀硫酸中(Cu2O
x。将此混合物溶于足量的稀硫酸中(Cu2O 2H
2H
 Cu
Cu Cu
Cu
 H2O),充分反应后过滤得到Cu y g,试求未被还原的CuO的物质的量(用含x、y的代数式表示)。
H2O),充分反应后过滤得到Cu y g,试求未被还原的CuO的物质的量(用含x、y的代数式表示)。
实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液
| 应量取盐酸体积/mL |
应选用容量瓶的规格/mL |
除容量瓶外还需要的其它仪器 |
| |
|
|
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) 。
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2—3cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是 。
溶液注入容量瓶前需恢复到室温,这是因为_______________________________。
(4)若出现如下情况,对所配溶液浓度将有何影响?没有进行A操作 ;加蒸馏水时不慎超过了刻度 ;定容时俯视__________(填“偏低”“偏高”“无影响”)
(5)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度 ;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面 。
相同体积的NaCl溶液(浓度为C1)和Na2SO4溶液(浓度为C2),若其中的Na+ 物质的量浓度相同,则它们的物质的量浓度C1和C2的关系是
| A.C1>C2 | B.C1=C2 | C.C1<C2 | D.2 C1=C2 |
将标准状况下的a 升氯化氢气体溶于100mL水中,得到的盐酸的密度为b克/毫升,则该盐酸的物质的量的浓度是( ) mol/L
| A.10 a /22.4 | B.10 a /22.4 (a +0.1) |
C. |
D.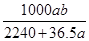 |
用NA表示阿伏加德罗常数的值,下列叙述不正确的是
| A.T℃时,1LpH=6的纯水中,含有的OH-数目为1×10-6NA |
| B.12.0gNaHSO4固体中含有的阳离子数目为0.1NA |
| C.50g98%的浓硫酸中,所含的氧原子数目为2NA |
| D.1molNa2O2与足量CO2充分反应转移的电子数目为NA |
硝酸是一种重要的工业原料,工业制硝酸的关键是氨的催化氧化,与硝酸工业相关的过程中产生的氮氧化物的处理与应用也是科学研究的热点。
I.图1、图2分别是实验室模拟合成氨及氨催化氧化的装置
(1)氮气和氢气通过图1装置,该装置中浓硫酸的作用是控制气体流速和 。
(2)用图2装置吸收一段时间氨后,再通入空气,同时将已经加热的铂丝插入乙装置的锥形瓶内,铂丝保持红热的原因是 ,写出该装置中氨氧化的化学方程式 。反应结束后锥形瓶内的溶液中含有H+、OH-、 离子、 离子。
II.下列有关硝酸事实的解释合理的是
| A.浓硝酸通常保存在棕色的试剂瓶中,说明浓硝酸不稳定 |
| B.足量铁与稀硝酸反应后溶液呈浅绿色,说明稀硝酸不能氧化亚铁离子 |
| C.不用浓硝酸与铜屑反应来制取硝酸铜,说明浓硝酸具有挥发性 |
| D.不用锌与稀硝酸反应制取氢气,说明稀硝酸能将锌钝化工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁。 |
(1)工业上常用Na2CO3溶液吸收法处理NOx 。
已知:NO不能与Na2CO3溶液反应
NO + NO2 + Na2CO3 = 2NaNO2 + CO2 ①
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2 ②
用足量的Na2CO3溶液完全吸收NOx,每产生5.6L(标准状况)CO2(全部逸出)时,吸收液质量就增加10g,则NOx中的x值为 。
(2)尿素也可用于吸收处理NOx,其反应原理为:
NO+NO2+H2O=2HNO2
2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
当混合气体中NO、NO2按上述反应中系数比时吸收效果最佳。若混合气体中V(NO)∶V(NO2)=3∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)= (空气中氧气的体积含量约为20%)。
绿矾(FeSO4·7H2O)硫酸法生产一种稀有金属产品过程中产出的副产品,产品外观为淡绿色或淡黄绿色结晶固体。加入适量可调节碱性水中的pH,与水中悬浮物有机结合,并加速沉淀,主要应用于水质净化和工业废水处理,同时具有杀菌作用。
(1)98% 1.84 g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为 (保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为 (填>、<、=")40%" 。
(2)实际生产用20%发烟硫酸(100克发烟硫酸含SO3 20克)配制稀硫酸,若用SO3·nH2O表示20%的发烟硫酸,则n=____________(保留两位小数)。
(3)绿矾在空气中容易被部分氧化为硫酸铁,现取7.32克晶体溶于稀盐酸后,加入足量的BaCl2溶液,过滤得沉淀9.32克;再通入112mL(标准状况)氯气恰好将Fe2+完全氧化,推测晶体的化学式为 。
(4)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在分析化学中常用来配制Fe2+的标准溶液,用此Fe2+的标准溶液可以测定剩余稀硝酸的量。现取8.64克Cu2S和CuS的混合物用200 mL 2 mol/L稀硝酸溶液处理,发生反应如下:
10NO3-+3Cu2S+16H+=6Cu2++10NO↑+3SO42-+8H2O
8NO3-+3CuS+8H+=3Cu2++3 SO42-+8NO↑+ 4H2O
剩余的稀硝酸恰好与V mL 2 mol/L (NH4)2Fe(SO4)2溶液完全反应。
已知:NO3-+3Fe2++4H+= NO↑+3Fe3++2H2O
①V值范围 ;
②若V=48,试计算混合物中CuS的质量分数 (保留两位小数)。
若以ω1和ω2分别表示浓度为a mol/L和b mol/L氨水的质量分数,且知2a=b,则下列推断正确的是(氨水的密度比纯水的小)
| A.2ω1 = ω2 | B.2ω2 = ω1 | C.ω2﹥2ω1 | D.2ω1﹥ω2﹥ω1 |
将质量分数为a%,物质的量浓度为c1 mol·L-1的稀H2SO4蒸发掉一定量的水,使之质量分数 变为2a%,此时该H2SO4的物质的量浓度为c2 mol·L-1,则c1和c2的数值关系是
| A.c2=2c1 | B.c2>2c1 | C.c2<2c1 | D.无法确定 |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.7.8g 由Na2S和Na2O2组成的混合物中含有阴离子的数目为 0.1NA |
| B.0.1mol苯中含有双键的数目为0.3 NA |
| C.标准状况下,22.4 L乙醇中含有分子的数目为NA |
| D.在过氧化钠与水的反应中,每生成0.1mol 氧气,转移电子的数目为0.4 NA |
硼和铝位于同一主族,它们可以形成许多组成和性质类似的化合物。一种用硼镁矿(Mg2B2O5·H2O)制取单质硼的工艺流程图如下: 
结合流程图回答下列问题:
(1)溶液a、溶液b中溶质的化学式分别为 . 。
(2)写出步骤①的化学方程式 。
(3)写出步骤②的离子方程式 。
(4)步骤③中化学反应可以发生的原因是 。
(5)过硼酸钠晶体(NaBO3·4H2O)是一种优良的漂白剂,在70℃以上加热会逐步失去结晶水。实验测得过硼酸钠晶体的质量随温度变化的情况如下图所示,则T2℃时所得晶体的化学式为 。 
NA代表阿伏加德罗常数的数值,下列说法正确的是
| A.1mol FeCl3完全水解生成NA个胶体粒子 |
| B.常温常压下,23g NO2分子总数小于0.5NA |
| C.标准状况下,2.24 L的CCl4中含有的C—Cl键数为0.4NA |
| D.6.8g熔融态KHSO4中含有0.1NA个阳离子 |
NA代表阿伏加德罗常数,下列有关叙述错误的是
| A.1mol 固体NaHSO4含有的阴阳离子总数为2NA |
| B.标准状况下22.4L CH4和C2H4的混合气体所含氢原子数为4NA |
| C.常温常压下,3.4gNH3中含N—H键数目为0.6NA |
| D.56 g铁粉在1mol氯气中充分燃烧,失去的电子数为3NA |