在2 L溶有0.2mol NaCl和0.2mol MgCl2的溶液中,Cl—的物质的量浓度为
| A.0.05 mol/L | B.0.1 mol/L | C.0.2 mol/L | D.0.3 mol/L |
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A.2.4g镁原子变成离子时,失去的电子数为0.3NA |
| B.22.4L甲烷(CH4)所含的原子数为5NA |
| C.98 g H2SO4和98 g H3PO4所含的氧原子数都是4NA |
| D.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为 NA |
现有装有物质的量浓度为1.2 mol/L的盐酸100ml的容器甲和装有物质的量浓度为1mol/L的硫酸100ml的容器乙,向甲.乙容器内加入相同质量的铝,充分反应后生成氢气的体积比为3:4(标准状况下),问所加入的铝的质量是( )
| A.1.08克 | B.1.44克 | C.1.8 克 | D.无法计算 |
用6.02×1023表示阿伏加德罗常数的值,下列说法中正确的是
| A.常温常压下,1.6 g臭氧中含有6.02×1022个氧原子 |
| B.标准状况下,2.24 L水中含有6.02×1022个水分子 |
| C.2.24 L氨气分子中含6.02×1023个电子 |
| D.2.4 g金属镁变为镁离子时失去6.02×1022个电子 |
NA为阿伏加德罗常数的值。下列说法中,正确的是
| A.标准状况下,22.4L庚烷的分子数约为NA |
| B.密闭容器中23gNO2与N2O4的混合气体中氮原子数为0.5NA |
| C.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA |
| D.1L0.1mol·L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA |
下列溶液中,c (Cl—)最小的是( )
| A.20 mL 0.5 mol/L AlCl3溶液 |
| B.30 mL 1 mol/L KCl溶液 |
| C.7.5 mL 2 mol/L MgCl2溶液 |
| D.10 mL 3 mol/L NaCl溶液 |
下列溶液中,和100mL 0.5mol/L NaCl溶液所含的Cl— 物质的量浓度相同的是( )
| A.100mL 0.5mol/L MgCl2溶液 |
| B.200mL 0.25mol/L AlCl3 |
| C.50ml 1mol/L NaCl溶液 |
| D.25ml 0.5mol/L HCl溶液 |
下列说法正确的是( )
| A.摩尔是物质的质量的单位 | B.氢气的摩尔质量是2g |
| C.1mo1OH-的质量是17 g | D.1mol气体所占的体积一定是22·4L |
设NA表示阿伏加德罗常数的值,下列说法中正确的是
| A.1mol金刚石中含有C-C键数目为4NA |
| B.56g铁粉在1mol Cl2中充分反应失去电子数为2NA |
| C.1L 0.1mol·L-1氨水中所含的离子和分子总数为0.1NA |
| D.标准状况下,44.8L NO2与N2O4混合气体中分子总数小于2NA |
设NA表示阿伏加德罗常数的值,下列说法正确的是
| A.常温下,1.0 L 1.0 mol.L-1 KAlO2溶液中含有的氧原子数为2NA |
| B.7.8gNa2O2固体中含有的阴离子数为0.2NA |
| C.标准状况下,体积为2.24 L的CO2和SO2的混合气体中含有的氧原子数为0.2 NA |
| D.0.l mol Cl2参加氧化还原反应,转移的电子数目一定是0.2NA |
单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点越高。下列溶液中沸点最高的是
| A.0.01 mol/L的蔗糖溶液 | B.0.01 mol/L的K2SO4溶液 |
| C.0.02 mol/L的NaCl溶液 | D.0.02 mol/L的CH3COOH溶液 |
下列叙述正确的是
| A.Na在足量O2中燃烧,消耗lmol O2时转移的电子数是4×6.02×1023 |
| B.盐酸和醋酸的混合溶液pH=1,该溶液中c(H+) =" 0.1" mol/L |
C.1 L 0.1 mol/L NH4Cl溶液中的NH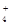 数是0.1×6.02×1023 数是0.1×6.02×1023 |
| D.标准状况下2.24 L Cl2中含有0.2 mol 共价键 |
设NA为阿伏加德罗常数的值,下列说法不正确的是
| A.80gCuO和Cu2S的混合物含有的Cu原子数一定是NA |
| B.标准状况下, 5.6L O2作为氧化剂时转移的电子数一定为NA |
| C.常温常压下,14g C2H4和C3H6混合气体中含有的原子数为3NA |
| D.25℃,1LpH=13的NaOH溶液中含有OH﹣的数目为 0.1NA |