由乙醛和丁酸、乙酸乙酯三种有机物按一定比例组成的混合物中,若含氧的质量分数为A%,则此混合物中含碳的质量分数为( )
| A.6A%/7 | B.(1-A%)/7 | C.6(1-A%)/7 | D.(100-7A/6)% |
下列说法中错误的是
| A.0.3 mol H2SO4 | B.1 molH2O | C.0.5 mol硫 | D.3 mol氢原子 |
下列各组物质中,所含分子数相等的是( )
| A.10g H2和10g O2 | B.5.6g N2(标准状况)和 11g CO2 |
| C.9g H2O 和0.5mol Br2 | D.224mL H2(标准状况)和0.1mol N2 |
用NA表示阿伏加德罗常数的值。下列判断正确的是
| A.常温常压下,32 g O3含有的氧原子数目为2 NA |
| B.56 g的Fe与足量的稀盐酸完全反应转移电子数为3NA |
| C.0.1 mol·L-1 Na2SO4溶液含有的钠离子数目为0.2 NA |
| D.标准状况下,22.4 L 四氯化碳(CCl4)含有的碳原子数目为NA |
设NA为阿伏加德罗常数的值,下列说法中正确的是
| A.0.1 mol溴苯中含有双键的数目为0.3NA |
| B.标准状况下,22.4 L己烷中含己烷分子数目为NA |
| C.1mol甲醇中含有C—H键的数目为4NA |
| D.标准状况下,11.2 L由CH4和C2H4组成的混合气体中含有氢原子的数目为2NA |
明矾石是制取钾肥和氢氧化铝的重要原料。明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示: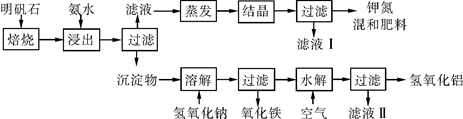
根据上述图示,完成下列填空。
(1)明矾石焙烧后用稀氨水浸出。配制500 mL稀氨水(每升含有39.20 g氨)需要取浓氨水(每升含有250.28 g氨)__________mL,用规格为__________mL量筒量取。
(2)写出沉淀物中所有物质的化学式:____________________。
(3)滤液Ⅰ的成分是水和________________________________。
(4)为测定混合肥料 K2SO4、(NH4)2SO4中钾的含量,完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量__________溶液,产生白色沉淀。
②__________、__________、__________(依次填写实验操作名称)。
③冷却、称重。
④若试样为m g,沉淀的物质的量为n mol,则试样中K2SO4的物质的量为___________mol(用含m、n的代数式表示)。
1.5mol N2、H2的混合气体和1.5mol NH3相比较,下列叙述中,一定正确的是
| A.体积相等 | B.原子数相等 | C.分子数相等 | D.质量相等 |
NA表示阿伏加德罗常数的值,下列说法中正确的是
| A.含0.1 mol BaCl2的溶液中Cl-数为0.1NA |
| B.22 g CO2所含有的分子数为0.5NA |
| C.11.2 L CO2所含有的分子数为0.5NA |
| D.常温下NA个Cl2分子所占有的体积为22.4 L |
下列溶液中与200mL 2mol/L CaCl2溶液中Cl-浓度相同的是:
| A.400mL 1mol/L NaCl溶液 | B.200mL 2mol/L AlCl3溶液 |
| C.100mL 1mol/L BaCl2溶液 | D.100mL 4mol/L KCl溶液 |
在标准状况下,下列物质中体积最大的是( )
| A.22.4 L H2 | B.含3.01×1023个分子的Cl2 |
| C.10g NH3 | D.0.8 mol SO2 |
下列说法正确的是( )
| A.摩尔是物质的量的单位 |
| B.溶液中或熔融状态下能导电的物质就是电解质 |
| C.氧化还原反应的本质是元素化合价发生了变化 |
| D.得电子的物质被还原,是还原剂 |
右图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是

| A.该硫酸试剂的物质的量浓度为18.4 mol/L |
| B.稀释该硫酸时应把水倒入硫酸中,边倒边搅拌 |
| C.50 mL该H2SO4中加入足量的铜片并加热,被还原的H2SO4的物质的量为0.46 mol |
| D.标准状况下2.7 g Al与足量的该硫酸反应可得到H2 3.36 L |
设NA表示阿伏加德罗常数的值。下列说法正确的是
| A.标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA |
| B.标准状况下,11.2LCH3CH2OH中含有的分子数目为0.5NA |
| C.常温常压下,18gH2O中含有的原子总数为3NA |
| D.常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.标准状况下,11.2LSO3所含的分子数为0.5NA |
| B.12g石墨和C60的混合物中质子总数一定为6NA |
| C.25℃时,1L mol•L-1FeCl3溶液中含有0.1NA个Fe(OH)3胶体粒子 |
| D.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA |