在一定温度下,下列叙述说明可逆反应A(g)+2B(g)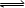
 2C(g) 达到平衡的( )
2C(g) 达到平衡的( )
A.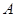 、 、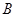 、 、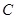 的浓度之比为1:2:2 的浓度之比为1:2:2 |
B.单位时间内消耗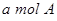 ,同时生成2a mol C ,同时生成2a mol C |
C.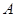 的浓度不再变化 的浓度不再变化 |
| D.混合气体总物质的量为2a mol |
在一定温度下,向aL密闭容器中加入1molX气体和2molY气体,发生如下反应:
X(g) + 2Y(g) 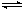 2Z(g) 此反应达到平衡的标志是
2Z(g) 此反应达到平衡的标志是
| A.正反应和逆反应的速率都为零 |
| B.容器内各物质的浓度不随时间变化 |
| C.容器内X、Y、Z的浓度之比为1∶2∶2 |
| D.单位时间消耗0.1molX同时生成0.2molZ |
下列叙述中可以说明反应2HI(g)  H2(g)+I2(g)已达平衡状态的是
H2(g)+I2(g)已达平衡状态的是
①单位时间内生成n mol H2的同时生成n mol HI ②一个H—H键断裂的同时有两个H—I键断裂 ③百分组成HI%=I2% ④反应速率v(H2)=v(I2)=1/2v(HI) ⑤[HI]∶[H2]∶[I2]=2∶1∶1 ⑥v(HI)分解=v(HI)生成 ⑦压强不变
| A.①③⑤ | B.②⑥ | C.④⑤ | D.④⑥⑦ |
硫酸是一种重要的化工产品,硫酸的消耗量常被视为一个国家工业发达水平的一种标志。目前主要生产方法是“接触法”,有关2SO2+O2 2SO3的说法中,不正确的是
2SO3的说法中,不正确的是
| A.该反应为可逆反应,故在一定条件下SO2和O2不可能全部转化为SO3 |
| B.达到平衡后,反应就停止了,故正、逆反应速率相等且均为零 |
| C.一定条件下,向某密闭容器中加入2 mol SO2和1 mol O2,则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻之后,正、逆反应速率相等 |
| D.平衡时SO2、O2、SO3的分子数之比不再改变 |
下图是可逆反应X2+3Y2 2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是
2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是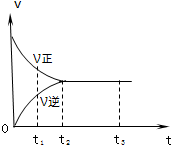
| A.t1时,只有正方向反应 | B.t1~t2时,X2的物质的量越来越多 |
| C.t2~t3,反应不再发生 | D.t2~t3,各物质的浓度不再发生变化 |
下列反应体系中,不属于可逆反应的是
| A.Cl2溶解于水 |
| B.氨气溶解于水 |
| C.工业合成氨 |
| D.水电解生成H2和O2与H2在O2中燃烧生成H2O |
已知反应I2(g)+H2(g) 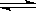 2HI(g) ΔH<0,下列说法正确的是( )
2HI(g) ΔH<0,下列说法正确的是( )
| A.降低温度,正向反应速率减小倍数大于逆向反应速率减小倍数 |
| B.升高温度将缩短达到平衡的时间 |
| C.达到平衡后,保持温度和容积不变,充入氩气,正、逆反应速率同等倍数增大 |
| D.达到平衡后,保持温度和压强不变,充入氩气,HI的质量将减小 |
在一密闭容器中充入1molNO2气体,建立如下平衡2NO2  N2O4,测得NO2转化率为a%。在温度、体积不变时,再通入1molNO2,待新平衡建立时,测得NO2的转化率为b%, a与b比较
N2O4,测得NO2转化率为a%。在温度、体积不变时,再通入1molNO2,待新平衡建立时,测得NO2的转化率为b%, a与b比较
| A.a>b | B.b>a | C.a=b | D.无法比较 |
高温下,某反应达平衡,平衡常数K= 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
A 升高温度,逆反应速率减小
B.恒温恒容下,增大压强,H2浓度一定减小
C.反应的焓变为正值
D.该反应化学方程式为CO + H2O CO2+ H2
CO2+ H2
一定温度下的恒容密闭容器中,发生反应如下:X(g) + 2Y(g) W(g) + Z(g),下列物理量不能用于表明反应是否已达到平衡状态的是
W(g) + Z(g),下列物理量不能用于表明反应是否已达到平衡状态的是
| A.Y的物质的量浓度 |
| B.混合气体的密度 |
| C.混合气体的压强 |
| D.混合气体的平均相对分子量 |
在一定条件下,对于反应mA(g)+nB(g)  pC(g)+qD(g),C物质的质量分数[w(C)]与温度、压强的关系如图所示,下列判断正确的是( )
pC(g)+qD(g),C物质的质量分数[w(C)]与温度、压强的关系如图所示,下列判断正确的是( )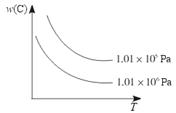
A.ΔH<0,m+n<p+q B.ΔH>0,m+n>p+q
C.ΔH>0,m+n<p+q D.ΔH<0,m+n>p+q
一定条件下反应A2(g)+B2(g) 2AB(g)达到平衡状态的标志是 ( )
2AB(g)达到平衡状态的标志是 ( )
A.2υ(正、A2)=υ(逆、AB)
B.容器内的总压强不随时间而变化
C.单位时间内生成n mol AB的同时,生成n mol的B2
D.A2、B2、AB的反应速率比为2:2:1的状态
将和
加入密闭容器中,在一定条件下发生反应:
。忽略固体体积,平衡时
的体积分数(%)随温度和压强的变化如下表所示。
| 压强/MPa 体积分数/% 温度/℃ |
1.0 |
2.0 |
3.0 |
| 810 |
54.0 |
a |
b |
| 915 |
c |
75.0 |
d |
| 1000 |
e |
f |
83.0 |
①b<f ②915℃、2.0MPa时E的转化率为60% ③该反应的 ④
上述①~④中正确的有()
A.4个 B.3个 C.2个 D.1个
在一定温度下,将气体和气体
各0.16
充入10
恒容密闭容器中,发生反应
+
 2
2
< 0,一段时间后达到平衡,反应过程中测定的数据如下表:
| 2 |
4 |
7 |
9 |
|
| 0.12 |
0.11 |
0.10 |
0.10 |
下列说法正确的是
| A. |
反应前2 |
| B. |
其他条件不变,降低温度,反应达到新平衡前 |
| C. |
该温度下此反应的平衡常数 |
| D. |
其他条件不变,再充入0.2 |