(1)在2L的密闭容器中,加入2molSO2、1.2molO2,充分反应后,容器内压强为反应前的3/4,则SO2、O2 的转化率分别为多少?
(2)将11. 2L标准状况下的甲烷和乙烯的混合气体通入足量的溴的四氯化碳溶液中充分反应,溴的四氯化碳溶液增加了5.6g,求原混合气体中甲烷与乙烯的质量之比。
恒温时,将2molA和2molB气体投入固定容积为2L密闭容器中发生反应:2A(g) + B(g) xC (g) + D(s)C500。5s时,测得A的物质的量为1.7mol,C的反应速率为0.045mol·L—1·s—1;40s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
xC (g) + D(s)C500。5s时,测得A的物质的量为1.7mol,C的反应速率为0.045mol·L—1·s—1;40s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
(1)x = 。
(2)从反应开始到40s达平衡状态,A的平均反应速率为 。
(3)平衡时容器中B的体积分数为 。
(4)该温度下此反应的平衡常数为 。
(5)下列各项能表示该反应达到平衡状态的是 。
A.消耗A的物质的量与生成D的物质的量之比为2∶1
B.容器中A、B的物质的量 n(A)∶n(B) =2∶1
C.气体的平均相对分子质量不再变化
D.压强不再变化
E.气体密度不再变化
在2 L和密闭容器中放入4mol ,发生如下反应:
,发生如下反应: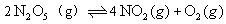 ,反应进行到5min时,测得
,反应进行到5min时,测得 转化了20%,求:
转化了20%,求:
(1)5min时,剩余 的物质的量;
的物质的量;
(2)前5min,v( )为多少;
)为多少;
(3)5min时,O2的物质的量占混合气体总物质的量的百分比。
吸热反应N2(g)+O2 (g)  2NO(g),在2000℃时,K=6.2×10-4.2000℃时,在10L密闭容器内放入3×10-3molNO、2.50×10-1molN2和4.00×10-2molO2,通过计算回答:(1)此反应的初始状态是否为化学平衡状态?
2NO(g),在2000℃时,K=6.2×10-4.2000℃时,在10L密闭容器内放入3×10-3molNO、2.50×10-1molN2和4.00×10-2molO2,通过计算回答:(1)此反应的初始状态是否为化学平衡状态?
(2)若非化学平衡状态,反应将向哪个方向进行?
(14分)Ⅰ.恒温、恒压下,在一个可变容积的密闭容器中发生如下反应:
A(g)+B(g) C(g)
C(g)
(1)若开始时放入1 mol A和1 mol B,达到平衡后,生成a mol C,这时A的物质的量为____ mol。
(2)若开始时放入3 mol A和3 mol B,达到平衡后,生成C的物质的量为__________ mol。
(3)若开始时放入x mol A、2 mol B和1 mol C,达到平衡后,A和C的物质的量分别是y mol和3a mol,则x="__________" mol,y="__________" mol。平衡时,B的物质的量__________(选填一个编号)。
A.大于2 mol B.等于2 mol
C.小于2 mol D.可能大于、等于或小于2 mol
作出此判断的理由是__________。
(4)若在(3)的平衡混合物中再加入3 mol C,待再次达到平衡后,C的物质的量分数是_______。
Ⅱ.若维持温度不变,在一个与I反应前起始体积相同且容积固定的容器中发生上述反应。
(5)开始时放入1 mol A和1 mol B,达到平衡后生成b mol C,将b与(1)小题中的a进行比较____________(选填一个编号)。
A.a<b B.a>b C.a="b " D.不能比较a和b的大小
作出此判断的理由是________________________________________________________。
某固定容积的2L密闭容器中进行反应 : 起始时加入的N2、H2、NH3均为2mol,5min后反应达到平衡, NH3的物质的量为3mol,求:
: 起始时加入的N2、H2、NH3均为2mol,5min后反应达到平衡, NH3的物质的量为3mol,求:
(1)这5分钟内用N2来表示该反应的反应速率(请写出计算过程,下同)
(2)求平衡时H2的物质的量浓度
(3)平衡时容器的压强为初始时的几分之几?
某温度下,在一个体积为2L的固定不变的密闭容器中充入0.3mol SO2和0.2mol O2,发生2 SO2+ O2 2 SO3反应。5分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90%。求
2 SO3反应。5分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90%。求
⑴以SO3的浓度变化表示该反应的化学反应速率;
⑵该反应中SO2的平衡转化率。
在某温度下,将H2(g)和I2(g)各0.1mol的气体混合物充入10L的密闭容器中,充分反应,达到平衡时,测得c(H2)=0.0080mol/L,
求:
(1)求该反应的平衡常数。
(2)在上述温度下,该容器中若充入的H2(g)和I2(g)各0.2mol,求达到化学平衡时HI(g)的平衡浓度。
在 2 L的密闭容器中, 充入 1 mol N2和 3 mol H2, 在一定的条件下反应, 2 分钟后达到平衡状态, 相同温度下, 测得平衡时混合气体的压强比反应前混合气体的压强减小了 1/10, 计算:(1) 平衡时混合气体中三种气体的物质的量比为多少?
(2) N2的转化率为多少?
(3) 2分钟内, NH3的平均反应速率为多少?
将1 mol氧气和一定量的HCl放入2L的密闭容器中,420℃时,在催化剂作用下发生反应:4HCl+O2 2Cl2+2H2O。5分钟后反应达到平衡,将容器中的混合气体通过过量NaOH溶液,消耗NaOH 2.0 mol;再将剩余气体干燥后通过焦性没食子酸的碱性溶液吸收O2,溶液增重19.2 g。
2Cl2+2H2O。5分钟后反应达到平衡,将容器中的混合气体通过过量NaOH溶液,消耗NaOH 2.0 mol;再将剩余气体干燥后通过焦性没食子酸的碱性溶液吸收O2,溶液增重19.2 g。
请回答下列问题:
(1)写出平衡时,混合气体通入NaOH溶液中所发生反应的离子方程式。
(2)计算0~5分钟时,Cl2的平均生成速率是多少。
(3)计算平衡时HCl的转化率。
在常压和500℃时把O2和SO2按1∶2 体积比混合,如果混合前O2有10 mol,
平衡时SO3占总体积的91% ,求:
(1)平衡时有多少摩O2转化?
(2)平衡时混合气中SO2的体积分数。
(3)SO2的转化率。
(4)若保持与前相同的条件,改用20molSO3代替O2和SO2,则达平衡时O2的体积分数为多少?
在1青团L含0.001 mol·L-1 SO 的溶液中,注入0.01 mol·L-1BaCl2,能否使SO
的溶液中,注入0.01 mol·L-1BaCl2,能否使SO 沉淀完全?〔已知Ksp(BaSO4)=1.08×10-10〕
沉淀完全?〔已知Ksp(BaSO4)=1.08×10-10〕
在某温度下,将H2和I2各0.10mol 的气态混合物充入10L的密闭容器中,充分反应,达到平衡后,测得 c(H2)= 0.0060mol/L
(1)求该反应的平衡常数。
(2)在上述温度下,该容器中若通入H2和I2蒸汽各0.20mol 的气态混合物,试求达到化学平衡状态时各物质的浓度
在一定温度下的密闭容器中存在如下反应:2SO2(g)+ O2 (g) 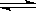 2SO3(g),已知c始(SO2)=0.4mol/L,c始(O2)=1mol/L,经测定该反应在该温度下的平衡常数K=19。判断:当SO2转化率为50%时,该反应是否达到平衡状态,若未达到,向哪个方向进行?(要求写出计算过程)
2SO3(g),已知c始(SO2)=0.4mol/L,c始(O2)=1mol/L,经测定该反应在该温度下的平衡常数K=19。判断:当SO2转化率为50%时,该反应是否达到平衡状态,若未达到,向哪个方向进行?(要求写出计算过程)
将等物质的量的A、B、C、D四种物质混合放入V L密闭容器中,发生如下反应:aA+bB cC(s)+dD,当反应进行到第t min时,测得A减少了n mol,B减少了
cC(s)+dD,当反应进行到第t min时,测得A减少了n mol,B减少了 mol,C增加了
mol,C增加了 mol,D增加了n mol。此时反应达到平衡。
mol,D增加了n mol。此时反应达到平衡。
(1)该化学方程式中,各物质的化学计量数分别为:a=__________、b=__________、c=__________、d=__________。
(2)以B的浓度变化表示的该化学反应的速率为v(B)=______________________________。
(3)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态是:A__________、B__________、D__________。
(4)若只升高温度,反应一段时间后,测知四种物质的物质的量又达到相等,则该反应为__________反应。(填“放热”或“吸热”)