在一体积为1L的密闭容器中,通入一定量的CO和H2O,在T1℃时发生如下反应:CO (g)+H2O(g)  CO2(g)+H2(g) △H<0,CO和H2O浓度变化如图,则
CO2(g)+H2(g) △H<0,CO和H2O浓度变化如图,则

(1) 0~4 min CO的平均反应速率v(CO)=___________mol/(L.min)。
(2)达平衡时CO的转化率为____________,T1℃时该反应的平衡常数K=_______________。
(3)T2℃(高于T1℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表:
| 时间(min) |
CO |
H2O |
CO2 |
H2 |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
C1 |
C2 |
C3 |
C3 |
| 4 |
C1 |
C2 |
C3 |
C3 |
| 5 |
0.116 |
0.216 |
0.084 |
C4 |
①表中3~4 min时,反应v正__________v逆(填“>”、“<”或“=”); C1___________0.08mol/L(填“>”、“<”或“=”)。
②4~5 min时,平衡向逆反应方向移动,可能的原因是__________(填字母)。
a.增加水蒸气 b.降低温度 c.增大了CO2浓度 d.增加了氢气浓度
在体积均为1.0 L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s)  2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是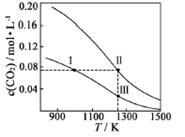
| A.化学平衡常数K:K(状态I)<K(状态II)<K(状态III) |
| B.CO2的平衡转化率α:α(状态I)<α(状态Ⅱ)=α(状态III) |
| C.体系中c(CO):c (CO,状态Ⅱ)<2c (CO,状态Ⅲ) |
| D.逆反应速率v逆:v逆(状态Ⅰ)>v逆(状态Ⅲ) |
在体积不变的400 ℃恒温密闭容器中,一定量的SO2与1 mol O2在催化剂作用下发生反应:
2SO2(g)+O2(g)  2SO3(g)ΔH =-Q kJ ∕ mol(Q﹥0)。当气体的物质的量减少0.5 mol
2SO3(g)ΔH =-Q kJ ∕ mol(Q﹥0)。当气体的物质的量减少0.5 mol
时反应达到平衡。下列叙述错误的是
| A.增大氧气浓度,平衡正向移动,平衡常数不变 |
| B.降低温度,正反应速率比逆反应速率减小的程度小 |
| C.平衡时SO2气体的转化率为50% |
| D.该条件下反应放出0.5Q kJ的热量 |
氨气在生产、生活和科研中应用十分广泛 。
(1)传统工业上利用氨气合成尿素
①以CO2与NH3为原料合成尿素的主要反应如下:
2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-159.47kJ/mol
NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+72.49kJ/mol
反应2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) ΔH=_____________kJmol。
②液氨可以发生电离:2NH3(l) NH2-+NH4+,COCl2和液氨发生“复分解”反应生成尿素,写出该反应的化学方程式______________。
NH2-+NH4+,COCl2和液氨发生“复分解”反应生成尿素,写出该反应的化学方程式______________。
(2)氨气易液化,便于储运,可利用NH3作储氢材料已知:2NH3(g) N2(g)+3H2(g) ΔH=+92.4 kJ/mol 。
N2(g)+3H2(g) ΔH=+92.4 kJ/mol 。
①氨气自发分解的反应条件是________________(填“低温” 或 “高温”)。
②其他条件相同,该反应在不同催化剂作用下反应,相同时间后,氨气的转化率随反应温度 的变化如图所示。

在600℃时催化效果最好的是________________(填催化剂的化学式)。c点氨气的转化率高于b点, 原因是________________。
(3)垃圾渗滤液中含有大量的氨氮物质(用NH3表示)和氯化物,把垃圾渗滤液加入到如图所示的电解池(电极为惰性材料)进行电解除去NH3,净化污水。该净化过程分两步:第一步电解产生氧化剂,第二步氧化剂氧化氨氮物质生成N2。
①写出电解时A极的电极反应式:________________。
②写出第二步反应的化学方程式:__________________。
在3个2 L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:
3H2(g)+N2(g) 2NH3(g)。按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
2NH3(g)。按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
下列说法正确的是
| A.容器乙中反应从开始到达平衡的反应速率为v(H2)=1.5mol·L-1·min-1 |
| B.2c1<1.5 |
| C.2ρ1=ρ2 |
D.在该温度下甲容器中反应的平衡常数 |
下列图示与对应的叙述相符的是( )
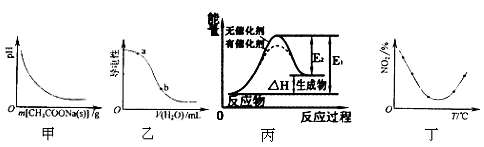
| A.图甲表示CH3COOH溶液中逐步加CH3COONa固体后,溶液pH的变化 |
| B.图乙表示在CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b |
| C.图丙表示催化剂能改变化学反应的焓变 |
D.图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应: 2NO2(g) N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 |
实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气
候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减
排的总体要求。试运用所学知识,解决下列问题:
(1)已知某反应的平衡常数表达式为: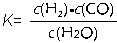 ,它所对应反应的化学方程式为 。
,它所对应反应的化学方程式为 。
(2)煤化工通常通过研究不同温度下的平衡常数以解决各种实际问题。已知等体
积的一氧化碳和水蒸气进入反应器时,会发生如下反应:
CO(g)+H2O(g)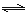 H2(g)+CO2(g)
H2(g)+CO2(g)
该反应的平衡常数随温度的变化如下表所示:
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数K |
9.94 |
9 |
1 |
①该反应的化学平衡常数表达式为K = 。
②该反应的正反应方向是 反应(填“吸热”或“放热”);
③若在500℃时进行,设CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化为 。
④800℃时,在固定容积的密闭容器中放入混合物,起始浓度为:c(CO)=0.01mol/L,c(H2O)=0.03mol/L,
c(CO2)=0.01mol/L,c(H2)=0.05mol/L,则反应开始时,H2O的消耗速率比生成速率 (填“大”、“小”或“不能确定”)。
(3)2SO2(g)+O2(g)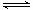 2SO3(g)反应过程中的能量变化如图所示:
2SO3(g)反应过程中的能量变化如图所示:
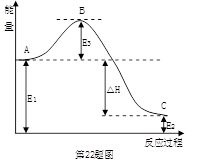
又已知1molSO2(g)氧化为1molSO3(g)的ΔH="-99" kJ·mol-1,
请回答下列问题:
 ①图中E1、E2分别表示 、 ,E3的大小对该反应的反应热 (填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点 (填“升高”或“降低”)△H (填“变大”、“变小”或“不变”),理由是____________________。
①图中E1、E2分别表示 、 ,E3的大小对该反应的反应热 (填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点 (填“升高”或“降低”)△H (填“变大”、“变小”或“不变”),理由是____________________。
 ②图中△H= kJ·mol-1。
②图中△H= kJ·mol-1。
氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气燃烧热值高。实验测得,在常温常压下1gH2完全燃烧生成液态水,放出142.9kJ热量。则表示H2燃烧热的热化学方程式为___________ 。
又已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ/mol,则氨在空气中燃烧生成液态水和氮气时的热化学方程式为 。
2NH3(g) ΔH=-92.4kJ/mol,则氨在空气中燃烧生成液态水和氮气时的热化学方程式为 。
(2)氢气是合成氨的重要原料。
①当合成氨反应达到平衡后,改变某一外界条件(不改变 N2、H2和NH3的量),反应速率与时间的关系如下图一所示。
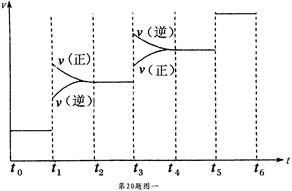
图中t1时引起平衡移动的条件可能是 ,其中表示平衡混合物中NH3的含量最高的一段时间
是 。
②温度为T℃时,将2a molH2和a molN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%。则反应
的平衡常数为 。
③氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。对于反应:N2O4(g) 2NO2(g) △H﹥0,在温度为T1、T2时,平衡体系中NO2的体积
2NO2(g) △H﹥0,在温度为T1、T2时,平衡体系中NO2的体积
分数随压强变化曲线如下图二所示。
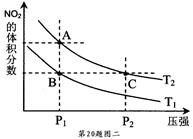
下列说法正确的是 。
a.A、C两点的反应速率:A﹤C
b.A、C两点的气体颜色:A浅,C深
c.B、C两点的气体平均相对分子质量:B﹤C
d.A、C两点的化学平衡常数:A﹥C
e.由状态B到状态A,可以用加热的方法
在容积相同的甲、乙两个容器中(如图所示),分别充入2molSO2和2molO2,使它们在相同温度下发生反应2SO2(g)+O2(g) 2S03(g)并达到平衡。在反应过程中,若甲容器的容积不变,乙容器的压强不变,甲中S02的转化率为a%,乙容器中SO2的转化率为b%,则a与b的关系为
2S03(g)并达到平衡。在反应过程中,若甲容器的容积不变,乙容器的压强不变,甲中S02的转化率为a%,乙容器中SO2的转化率为b%,则a与b的关系为
| A.a﹥b | B.a=b | C.a﹤b | D.无法确定 |
在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g) zC(g)。平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低0.30mol/L。下列有关判断正确的是
zC(g)。平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低0.30mol/L。下列有关判断正确的是
| A.x+y﹤z | B.平衡向正反应方向移动 |
| C.B的转化率降低 | D.C的体积分数升高 |
用来表示可逆反应:2A(g)+B(g) 3C(g)(正反应放热)的正确图像是
3C(g)(正反应放热)的正确图像是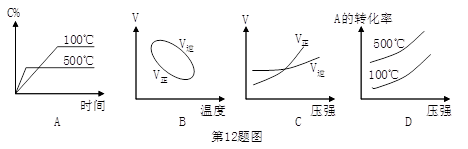
经一定时间后,可逆反应aA+bB cC中物质的含量A%和C%随温度的变化曲线如下图所示,下列说法正确的是
cC中物质的含量A%和C%随温度的变化曲线如下图所示,下列说法正确的是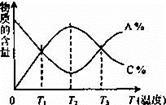
| A.该反应在T1、T3温度时达到化学平衡 |
| B.升高温度,平衡会向正反应方向移动 |
| C.该反应的逆反应是放热反应 |
| D.该反应在T2温度时达到化学平衡 |
汽车尾气中排放的NO和CO,可以通过加装催化转化器,使之转化为两种无污染的气体,
2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=-748 kJ/mol
N2(g)+2CO2(g) ΔH=-748 kJ/mol
在一定温度下,向2L的密闭容器中充入2.0molNO2.0molCO,在催化剂作用下发生反应,相关数据如下:
| |
0 min |
5min |
10min |
15min |
20min |
| c(NO) |
1.0 |
0.6 |
0.3 |
0.2 |
0.2 |
| c(N2) |
0 |
0.2 |
0.35 |
0.4 |
0.4 |
(1)5—10min,用CO的浓度变化表示的反应速率为: ;
(2)能说明上述反应达到平衡状态的是
A.2n正(NO) =n逆(N2) B.混合气体的平均相对分子质量不变
C.NO和CO的转化率相等 D.容器内气体压强不变
(3)20min时,向容器中加入1molNO和1molCO,再次达到平衡时,NO的转化率: (填“变大”、“ 变小”或“不变”)。
(4)计算此温度下的化学平衡常数K= ,或保持温度不变,此时再向容器内加入CO和CO2各1mol,平衡 移动(填“向左”、“ 向右”或“不”)。
(5)若反应开始向容器中加入1molN2和2molCO2,反应达到平衡时,吸收热量为 kJ。
化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是( )
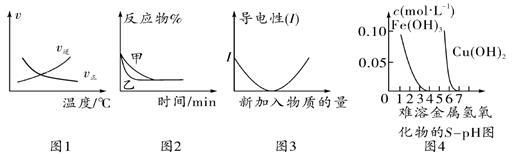
A.根据图1可判断可逆反应“A2(g)+3B2(g) 2AB3(g)”的 ΔH<0 2AB3(g)”的 ΔH<0 |
B.图2可能表示压强对可逆反应 A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大 3C(g)+D(s)的影响,乙的压强大 |
| C.图3可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 |
| D.根据图4,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量Cu至pH在4左右 |