已知反应:2SO2(g)+O2(g)  2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )

| A.由图甲知,A点SO2的平衡浓度为0.4 mol·L-1 |
| B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2∶1∶2 |
| C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示 |
| D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1 |
在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:H2(g)+ I2(g) 2HI(g) ΔH<0。反应中各物质的浓度随时间变化情况如图1:
2HI(g) ΔH<0。反应中各物质的浓度随时间变化情况如图1:
(1)该反应的化学平衡常数表达式为 。
(2)根据图1数据,反应开始至达到平衡时,平均速率v(HI)为 。

(3)反应达到平衡后,第8分钟时:
①若升高温度,化学平衡常数K (填写增大、减小或不变),HI浓度的变化正确的是 (用图2中a-c的编号回答)。

②若加入I2,则H2浓度的变化正确的是 (用图2中d-f的编号回答)。
在密闭容器中投入一定量的A和B发生反应:m A(g)+n B(g) p C(g)+q D(g)。
p C(g)+q D(g)。
(1)若开始时加入A物质m mol,B物质n mol,则达到平衡时 A、B的转化率____________.(填“相等”或“不等”)
(2)相同的压强下,充入一定量的A、B后,在不同温度下C的百分含量与时间T的关系如图3所示。则T1(填“>”、“<”或“=”) T2,该反应的正反应的△H(填“>”、“<”或“=”) 0。

(3)一定条件下,从正反应开始达到化学平衡过程中,混合气体的平均相对分子质量随时间的变化如图4所示,测得达到平衡时A、B、C、D的物质的量均为1 mol。

①若在恒温恒容的条件下,向原平衡体系中再通入A、B、C、D各1 mol,则体系中气体的平均相对分子质量(填“增大”、“减小”、“不变”或“无法确定”)______ 。
②若恒温恒压的条件下,向原平衡体系中再通入A、B、C、D各1 mol,则体系中气体的密度(填“增大”、“减小”、“不变”或“无法确定”) 。
(4)若该反应的逆反应速率与时间的关系如下图所示:

可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了条件,试判断t2时改变的条件是 。
相同温度下,体积均为0.25 L的两个恒容容器中发生可逆反应:
X2(g)+3Y2(g) 2XY3(g) ΔH=-92.6 kJ·mol-1,实验测得反应在起始、达到平衡时的有关数据如下表所示:
2XY3(g) ΔH=-92.6 kJ·mol-1,实验测得反应在起始、达到平衡时的有关数据如下表所示:
| 容器 编号 |
起始时各物质物质的量/mol |
达平衡时体系 能量的变化 |
||
| X2 |
Y2 |
XY3 |
||
| ① |
1 |
3 |
0 |
放热46.3 kJ |
| ② |
0.8 |
2.4 |
0.4 |
Q(Q>0) |
下列叙述不正确的是
A.容器①、②中反应平衡时XY3的平衡浓度相同
B.容器①、②中达到平衡时各物质的百分含量相同
C.达平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
D.若容器①体积为0.20 L,则达平衡时放出的热量大于46.3 kJ
已知2A(g)+B(g) 2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)="0.040" mol·L-1,放出热量Q1kJ。
2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)="0.040" mol·L-1,放出热量Q1kJ。
(1)能说明上述反应已经达到化学平衡状态的是 (填写序号)。
A.v(C)=2v(B)
B.容器内压强保持不变
C.v逆(A)=2v正(B)
D.容器内气体的密度保持不变
(2)若在相同的容器中只加入0.050 mol C,500℃时充分反应达平衡后,吸收热量Q2kJ,则Q1与Q2之间的关系式可表示为 (用含Q1、Q2的代数式表示);
(3)500℃时,上述反应的化学平衡常数K= 。
(4)已知:K(300℃)>K(350℃),该反应是 (填“放”或“吸”)热反应;若反应温度升高,A的转化率 (填“增大”、“减小”或“不变”)。
(5)某温度下,A的平衡转化率(a)与体系总压强(P)的关系如图所示,平衡状态由a 变到b时,化学平衡常数K(A) K(B)(填“>”、“<”或“=”)。

下列说法不正确的是
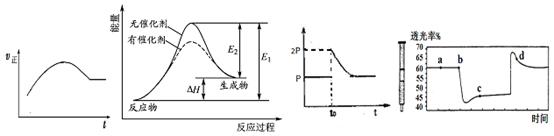
甲 乙 丙 丁
A.绝热恒容密闭容器中通入A和B,发生反应:2A (g)+B (g)  2C(g),图甲为其正反应速率随时间变化的示意图,则该反应为放热反应。 2C(g),图甲为其正反应速率随时间变化的示意图,则该反应为放热反应。 |
| B.催化剂能降低反应的活化能,提高活化分子的百分含量,从而加快化学反应速率。图乙显示的是催化反应与无催化反应过程中的能量关系。 |
C.将BaO2放入密闭真空容器中,反应2BaO2(s)  2BaO(s)+O2(g)达到平衡时体系压强为P,保持温度不变,t0时刻将容器体积缩小为原来的1/2,体系重新达到平衡,体系压强变化如图丙所示。 2BaO(s)+O2(g)达到平衡时体系压强为P,保持温度不变,t0时刻将容器体积缩小为原来的1/2,体系重新达到平衡,体系压强变化如图丙所示。 |
D.将一定量的NO2充入针筒中后封口,发生反应2NO2 (g) N2O4(g),图丁表示在拉伸和压缩针筒活塞的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。则c点与a点相比,c(NO2)增大,c(N2O4)减小。 N2O4(g),图丁表示在拉伸和压缩针筒活塞的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。则c点与a点相比,c(NO2)增大,c(N2O4)减小。 |
如图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器。当其它条件相同时,在Ⅰ、Ⅱ中分别加入2 mol X和2 mol Y,开始时容器的体积均为V L,发生如下反应并达到平衡状态: 2X(?)+Y(?) aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。下列判断正确的是
aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。下列判断正确的是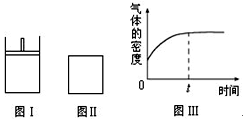
| A.物质Z的化学计量数a = 2 |
| B.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y中只有一种为气态 |
| C.若X、Y均为气态,则在平衡时X的转化率:Ⅰ﹤Ⅱ |
| D.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ |
在一定的温度下, 向一密闭容器中放入 1 mol A 和 1 mol B, 发生下列反应:A(g) + B(g)  C(g) + 2D(g),达到平衡状态时,C的含量为 m%,保持温度和体积不变,若按照下列配比在上述容器放入起始物质,达到平衡状态时C的含量仍然为m%的是
C(g) + 2D(g),达到平衡状态时,C的含量为 m%,保持温度和体积不变,若按照下列配比在上述容器放入起始物质,达到平衡状态时C的含量仍然为m%的是
| A.2mol A + 1mol B |
| B.1mol C + 1mol D |
| C.2mol C + 2mol D |
| D.0.5mol A +0.5mol B +0.5mol C +1mol D |
在密闭容器中发生下列反应aA(g) cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
| A.A的转化率变大 | B.平衡向正反应方向移动 |
| C.D的体积分数变大 | D.a < c+d |
碳酸二甲酯(CH3OCOOCH3,简称DMC),是一种无毒、用途广泛的化工原料,被誉为当今有机合成的“新基石”。
(1)浙江大学用甲醇、CO、O2在常压、70~120℃和催化剂的条件下合成DMC的研究开发。
已知:ⅰ CO的标准燃烧热:-283.0 kJ•mol-1,
ⅱ 1mol H2O(l)完全蒸发变成H2O(g)需吸收44 kJ的热量
ⅲ 2CH3OH(g)+CO2 (g) 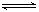 CH3OCOOCH3 (g)+H2O(g) △H=-15.5 kJ•mol-1
CH3OCOOCH3 (g)+H2O(g) △H=-15.5 kJ•mol-1
则2CH3OH(g)+CO(g)+ 1/2O2(g) 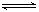 CH3OCOOCH3 (g)+H2O(l) △H= 。该反应在常压和70~120℃条件下就能自发反应的原因是 。
CH3OCOOCH3 (g)+H2O(l) △H= 。该反应在常压和70~120℃条件下就能自发反应的原因是 。
(2)甲醇和CO2可直接合成DMC:2CH3OH(g)+CO2 (g) 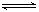 CH3OCOOCH3 (g)+ H2O(g),但甲醇转化率通常不会超过1%,制约该反应走向工业化生产。
CH3OCOOCH3 (g)+ H2O(g),但甲醇转化率通常不会超过1%,制约该反应走向工业化生产。
① 写出该反应平衡常数表达式: 。
②在恒容密闭容器中发生上述反应,能说明已达到平衡状态的是 (选填编号)。
A.v正(CH3OH)= 2v逆(CO2)
B.CH3OCOOCH3与H2O的物质的量之比保持不变
C.容器内气体的密度不变
D.容器内压强不变
③某研究小组在某温度下,在100mL恒容密闭容器中投入2.5 molCH3OH(g)、适量CO2和6×10-5 mol催化剂,研究反应时间对甲醇转化数(TON)的影响,其变化曲线如下左图所示。计算公式为:TON = 转化的甲醇的物质的量/催化剂的物质的量。
在该温度下,最佳反应时间是 ;4~10 h内DMC的平均反应速率是_ ___。
④如果在其它条件不变的情况下,研究反应温度对甲醇转化数(TON)的影响,请在右上图坐标系中画出从投入反应物开始,随着反应温度不断升高(不考虑温度对催化剂活性的影响),TON变化的曲线示意图(假设起始温度为T0℃)。
⑤假设在密闭容器中发生上述反应,达到平衡时下列措施能提高TON值的是 。
A.往反应体系中添加催化剂
B.往反应体系中添加吸水剂
C.从反应体系中分离出CO2
D.扩大容器的体积
在容积不变的密闭容器中进行反应:2SO2(g)+O2(g) 2SO3(g) △H<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
2SO3(g) △H<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是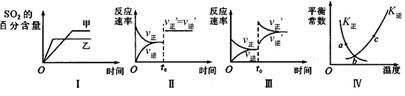
| A.图I表示温度对化学平衡的影响,且甲的温度较高 |
| B.图Ⅱ表示t0时刻使用催化剂对反应速率的影响 |
| C.图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响 |
| D.图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态 |
某硫酸厂用以下几种方法处理SO2尾气。

(1)活性炭还原法
反应原理:恒温恒容2C (s)+2SO2(g) S2(g)+2CO2(g) 。
S2(g)+2CO2(g) 。
反应进行到不同时间测得各物质的浓度如图:
①第一次出现平衡的时间是第 min;
②0~20min反应速率表示为V(SO2)= ;
③30 min时,改变某一条件平衡发生移动,则改变的条件最有可能是 ;40min时,平衡常数值为__________。
(2)亚硫酸钠吸牧法
①Na2SO3溶液吸收SO2的离子方程式为 ;
②常温下,当吸收至pH=6时,吸收液中相关离子浓度关系一定正确的是____(填序号)
a.c(Na+)+c(H+) >c(SO32-)+c(HSO3-)+ c(OH-)
b.c(Na+) = c(SO32-) + c(HSO3-)+ C(H2SO3)
c.c(Na+)> c(SO32-)> c(OH-)>c(H+)
d.水电离出c(OH一)=l×l0-8 mol/L,
(3)电化学处理法
如图所示,Pt(1)电极的反应式为 ;碱性条件下,用Pt(2)电极排出的S2O42-溶液吸收NO2,使其转化为N2,同时有SO32-生成。若阳极转移电子6mol,则理论上处理NO2气体 mol。

在1.0L密闭容器中放入l.0molX(g),在一定温度进行如下反应:X(g) Y(g) +Z(g)△H=akJ.mol-1反应时间(t)与容器内气体总压强(p)的数据见下表:
Y(g) +Z(g)△H=akJ.mol-1反应时间(t)与容器内气体总压强(p)的数据见下表:

回答下列问题:
(1)实验测得,随温度的升高反应的平衡常数K增大,则△H__________0(填>、<或=)
(2)其他条件不变时,为使平衡向右移动,采用的下列措施可行的是__________。
| A.缩小容器容积 | B.及时分离出Y、Z | C.使用合理的催化剂 | D.升高体系温度 |
(3)计算平衡时X的转化率为__________,该温度下反应的平衡常数值为:___________。
(4)由总压强p和起始压强po表示反应体系的总物质的量n(总)和反应物X的物质的量n(X),则n(总)=__ mol,n(X)=__ mol,反应物X的转化率a(X)的表达式为_________。
X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如下图所示变化:

已知一个B分子中含有的Z元素的原子个数比C
分子中的少一个。请回答下列问题:
(1)Y单质分子的电子式为 。
(2)X的单质与Z的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入 (填物质名称或化学式均可);负极电极反应式为 。
(3)已知Y的单质与Z的单质生成C的反应是可逆反应,将等物质的量的Y、Z的单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法中,正确的是__________(填写下列各项的序号)。
a.达到化学平衡时,正反应速率与逆反应速率相等
b.反应过程中,Y的单质的体积分数始终为50%
c.达到化学平衡时,Y、Z的两种单质在混合气体中的物质的量之比为1:1
d.达到化学平衡的过程中,混合气体平均相对分子质量逐渐减小