在容积固定的容器中发生反应X(g)+Y(g)  Z(g)(未配平)。温度为T0时,各物质的浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。下列叙述正确的是
Z(g)(未配平)。温度为T0时,各物质的浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。下列叙述正确的是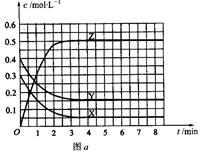
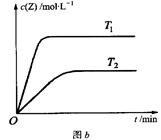
| A.该反应正反应的反应热ΔH < 0 |
| B.增大压强,平衡向正反应方向移动 |
| C.图a中反应达到平衡时,Y的转化率为62.5% |
| D.发生反应时,各物质的反应速率大小关系为:v(X)= v(Y)= 2v(Z) |
已知N2(g) +3H2(g)  2NH3(g) △H =-92.3kJ·mol-1,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN2和3molH2,达到平衡状态I;相同条件下,向另一体积相同的密闭容器中通入0.9molN2、2.7molH2和0.2molNH3,达到平衡状态II,则下列说法正确的是
2NH3(g) △H =-92.3kJ·mol-1,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN2和3molH2,达到平衡状态I;相同条件下,向另一体积相同的密闭容器中通入0.9molN2、2.7molH2和0.2molNH3,达到平衡状态II,则下列说法正确的是
| A.两个平衡状态的平衡常数的关系:KI < KII | B.H2的百分含量相同 |
| C.N2的转化率:平衡I <平衡II | D.反应放出的热量:QI =QII < 92.3 kJ |
工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
某研究小组分别在体积均为2 L的恒容密闭容器中加入一定量的反应物,使其发生反应,相关数据如下:
| 容器 编号 |
温度 /℃ |
起始量/mol |
平衡量/mol |
达到平衡的时间/min |
达平衡时体系能量的变化/kJ |
||
| CO |
H2O |
CO2 |
H2 |
||||
| ① |
650 |
1 |
2 |
0.4 |
0.4 |
5 |
16.4kJ |
| ② |
650 |
2 |
4 |
|
|
t1 |
Q1 kJ |
| ③ |
900 |
2 |
4 |
1.6 |
1.6 |
t2 |
Q2 kJ |
(1)计算容器②中反应的平衡常数K= (计算结果保留两位小数)。
(2)容器③中反应达平衡时,CO的转化率为 。
(3)容器①中反应达平衡这段时间,化学反应速率v (H2) = 。
(4)该反应的正反应为 (填“吸热”或“放热”)反应,理由是 。
(5)下列叙述正确的是 (填字母序号)。
a.平衡时,容器①和容器②中CO2的体积分数相等
b.反应达平衡状态时,Q2 > Q1> 32.8 kJ
c.达到平衡的时间:t2> t1>2.5 min
d.该反应的热化学方程式可表示为:CO(g)+H2O(g)  CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
(6)容器②中反应进行到t min时,测得混合气体中CO2的物质的量为0.6 mol。若用200 mL 5 mol/L的NaOH溶液将其完全吸收,得到的溶液中所有离子的物质的量浓度由大到小的顺序为 。