下列各表述与示意图不一致的是 ( )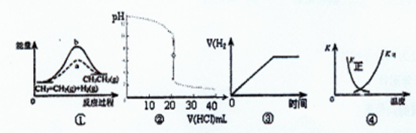
| A.图①中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)+Q使用和未使用催化剂时,反应过程中的能量变化 |
| B.图②表示25℃时,用0.1 mol·L—盐酸滴定20mL 0.1 mol·L-1NaOH溶液,溶液的pH随加入酸体积的变化 |
| C.图③表示锌粒与过量稀盐酸反应时,V(H2)随时间的变化图 |
D.图④中曲线表示反应2SO2(g)+O2(g) SO3(g)+Q正、逆反应的平衡常数K随温度的变化 SO3(g)+Q正、逆反应的平衡常数K随温度的变化 |
已知可逆反应:4NH3(g)+5O2(g)  4NO(g)+6H2O(g) ΔH=-1 025 kJ/mol,
4NO(g)+6H2O(g) ΔH=-1 025 kJ/mol,
若反应物的起始物质的量相同,下列关于该反应的示意图不正确的是:( ) 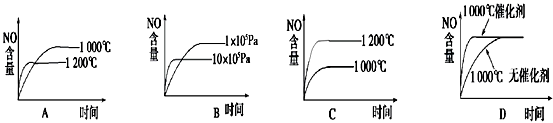
为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究。
(1)① 把含有较高浓度CO2的空气通入饱和K2CO3溶液。
② 在①的吸收液中通高温水蒸气得到高浓度的CO2气体。
写出②中反应的化学方程式________。
(2)如将CO2与H2以1:3的体积比混合。
①适当条件下合成某烃和水,该烃是_______(填序号)。
| A.烷烃 | B.烯烃 | C.炔烃 | D.苯的同系物 |
② 适当条件下合成燃料甲醇和水。在体积为2L的密闭容器中,充入2 mol CO2和6 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。
CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。
测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
从反应开始到平衡,v(H2)=______;氢气的转化率=_______;能使平衡体系中n(CH3OH)增大的措施有______。
(3)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。
已知:
CH4 (g) + 2O2(g)  CO2(g)+ 2H2O(l) ΔH1=― 890.3 kJ/mol
CO2(g)+ 2H2O(l) ΔH1=― 890.3 kJ/mol
H2(g) + 1/2O2(g)  H2O(l) ΔH2=-285.8 kJ/mol
H2O(l) ΔH2=-285.8 kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是________。
(4)某同学用沉淀法测定含有较高浓度CO2的空气中CO2的含量,经查得一些物质在20℃的数据如下表。
| 溶解度(S)/g |
溶度积(Ksp) |
||
| Ca(OH)2 |
Ba(OH)2 |
CaCO3 |
BaCO3 |
| 0.16 |
3.89 |
2.9×10-9 |
2.6×10-9 |
(说明:Ksp越小,表示该物质在水溶液中越易沉淀)
吸收CO2最合适的试剂是_________[填“Ca(OH)2”或“Ba(OH)2”]溶液,实验时除需要测定工业废气的体积(折算成标准状况)外,还需要测定__________。
网向甲乙两个容积均为1L的恒容容器中,分别充入2mol A、4molB和1molA、2molB。相同条件下,发生下列反应:A(g)+2B(g)  xC(g) ΔH<0。测得两容器c(A)随时间t的变化如图所示,下列说法正确的是
xC(g) ΔH<0。测得两容器c(A)随时间t的变化如图所示,下列说法正确的是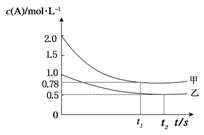
A.x可能等于3
B.向平衡后的乙容器中充入氦气可使A的转 化率降低
C.将乙容器单独升温,c(A)可达到0.78 mol·L-1
D.若向甲容器中再充入2molA、4molB,平衡时甲容器中c(A)等于1.56 mol·L-1
373K时,某 1L密闭容器中加入1mol NH3发生如下可逆反应: 2NH3(g) N2(g)+ 3 H2(g)。其中物质H2的物质的量变化如下图所示。
N2(g)+ 3 H2(g)。其中物质H2的物质的量变化如下图所示。
(1)前 20 s内NH3(g)的平均反应速率为 
(2)373K时该反应的平衡常数的值为
(3)若在此平衡体系中再加入 1mol的NH3,与原平衡比较,新平衡时 NH3的转化率 (填“增大”或“减小”,下同)。NH3的平衡浓度 。
(4)将原平衡升温至 473K,重新达平衡时(其他条件不变),H2的平衡浓度为NH3的2倍,该反应的正反应为(填“放热反应”或 “吸热反应”) ,为增大平衡体系中H2的物质的量,下列措施正确的是(其它条件相同)
a.升高温度 b.扩大容器的体积 c.加入合适的催化剂  d.再充入N2
d.再充入N2
低碳经济呼唤新能源和清洁环保能源。煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题。
已知:CO(g) + H2O(g) H2(g) + CO2(g)的平衡常数随温度的变化如下表:
H2(g) + CO2(g)的平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
850 |
| 平衡常数 |
9.94 |
9 |
1 |
请回答下列问题:
(1)上述正反应方向是 反应(填“放热”或“吸热”)。
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g)发生上述反应,CO和H2O(g)浓度变化如下图,则0~4 min的平均反应速率v(CO)=______ mol/(L·min)
| 时 间(min) |
CO |
H2O |
CO2 |
H2 |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
 3 3 |
C1 |
C2 |
C3 |
C3 |
| 4 |
C1 |
C2 |
C3 |
C3 |
| 5 |
0.116 |
0.216 |
0.084 |
|
| 6 |
0.096 |
0.266 |
0.104 |
|
| t1℃时物质浓度(mol/L)的变化 |
||||

(3) t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3 min~4 min之间反应处于_____状态;C1数值_____0.08 mol/L (填大于、小于或等于)。
②反应在4 min~5 min,平衡向逆方向移动,可能的原因是____(单选),表中5 min~6 min之间数值发生变化,可能的原因是______(单选)。
| A.增加水蒸气 | B.降低温度 | C.使用催化剂 | D.增加氢气浓度 |
(4)若在500℃时进行,若CO、H2O的起始浓度均为0.020mol/L,在该条件下,CO的最大转化率为: 。
(5)若在850℃进行,设起始时CO和H2O(g)共为5mol,水蒸气的体积分数为X;平衡时CO转化率为Y,试推导Y随X变化的函数关系式为 。
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。高炉内可能发生如下反应:
C(s)+O2 (g) = CO2(g) △H1=-393.5 kJ·mol—1 ①
(g) = CO2(g) △H1=-393.5 kJ·mol—1 ①
C(s)+CO2(g) = 2CO(g) △H2=+172.5 kJ·mol—1 ②
4CO(g)+Fe3O4(s) = 4CO2(g)+3Fe(s) △H3=-13.7 kJ·mol—1 ③
请回答下列问题:
⑴计算3Fe(s)+2O2(g) = Fe3O4(s)的△H= ▲ 。
⑵800℃时,C(s)+CO2(g) 2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.20mol·L-1、c(CO2)=0.05mol·L-1,此时反应向 ▲ (填“正”或“逆”)方向进行。
2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.20mol·L-1、c(CO2)=0.05mol·L-1,此时反应向 ▲ (填“正”或“逆”)方向进行。
⑶某种矿石中铁元素以氧化物FemOn形式存在,现进行如下实验:将少量铁矿石样品粉碎,称取25.0 g样品于烧杯中,加入稀硫酸充分溶解,并不断加热、搅拌,滤去不溶物。向所得滤液中加入10.0 g铜
粉充分反应后过滤、洗涤、干燥得剩余固体3.6 g。剩下滤液用浓度为2mol·L-1的酸性KMnO4滴定,至终点时消耗KMnO4溶液体积25.0 mL。
提示:2Fe3++Cu=2Fe2++Cu2+ 8H++MnO4-+5Fe2+=Mn2++5Fe3++4H2O
①计算该铁矿石中铁元素的质量分数。
②计算氧化物FemOn的化学式(m、n为正整数)
向甲乙两个容积均为1L的恒容容器中,分别充入2molA、2molB和1molA、1molB。相同条件下,发生下列反应:A(g)+B(g) xC(g);△H<0。测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是 ( )
xC(g);△H<0。测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是 ( )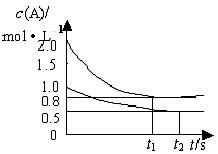
A.x等于1
B.向平衡后的乙容器中充入氦气可使c(A)增大
C.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同
D.若向甲容器中再充入2molA、2molB,则平衡时甲容器中0.7mol<n(B)<1.4mol
在一固定容积为2L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应: N2(g)+3H2(g) 2NH3(g) △H <0
2NH3(g) △H <0
(1)该反应450℃的平衡常数 500℃时的平衡常数(填“>”、“<”或“=”);
(2)下列描述中能说明上述反应已达平衡的是
a.3v正(H2)=2v逆(NH3) b.容器中气体的平均相对分子量不随时间而变化
c.容器中气体的密度 不随时间而变化 d.容器中气体的分子总数不随时间而变化
不随时间而变化 d.容器中气体的分子总数不随时间而变化
(3)上述反应若第5分钟时达到平衡,测得NH3的物质的量为0.2mol
计算从反应开始到平衡时,平均反应速率v(N2)为 mol/(L·min)
(4)保持其他条件不变,若初始投入量为amolN2、bmolH2、cmolNH3,也可得到与上述相同的平衡,则a、b、c需满足关系式: ;
(5)第5分钟末,保持其它条件不变, 若继续通入0.2 mol的N2和0.6 mol的H2,
则平衡 移动(填“向正反应方向”“向逆反应方向”或“不”)。
在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:
C(s)+H2O(g)
 CO(g)+H2(g)
CO(g)+H2(g)
试分析和回答下列问题:
(1)可认定上述可逆反应在一定条件下已达到化学平衡状态的是 (选填序号)。
A 体系 的压强不再发生变化
的压强不再发生变化
B v正(CO)=v逆(H2O)
C 生成n molCO的同时生成n mol H2
D 1mol H-H键断裂的同时断裂2mol H-O键
(2)若上述化学平衡状态从 正反应开始建立,达到平衡后,给平衡体系加压(缩小容积.其它条件不变。下同),则容器内气体的平均相对分子质量面将 (填写不变.变小.变大)。
正反应开始建立,达到平衡后,给平衡体系加压(缩小容积.其它条件不变。下同),则容器内气体的平均相对分子质量面将 (填写不变.变小.变大)。
(3)若上述化学平衡状态从正.逆两反应同时建立[即起始时同时投放C(s).H2O(g).CO(g).H2(g)],达到平衡后,试讨论:
①容积内气体混合物的平均相对分子质量 的取值范围是 。
的取值范围是 。
②若给平衡体系加压,请参照起始投放的气体物质的平均相对分子质量(设定为 1),分别给出
1),分别给出 的变化:(填“增大”.“减小”.“不变”)
的变化:(填“增大”.“减小”.“不变”)
 1的取值 1的取值 |
 的变化 的变化 |
 1<12 1<12 |
|
 1=12 1=12 |
不变 |
 1>12 1>12 |
|
Ⅰ.如下图所示,将2molA气体和1molB气体充入一容积可变的密闭容器中,发生反应:2A(g)+B(g)  2C(g).反应开始时可滑动的活塞的位置如甲图所示,当反应达到平衡时,活塞位置如乙图所示。则当达到平衡时,A的转化率为 ;该条件下的反应的平衡常数为 。
2C(g).反应开始时可滑动的活塞的位置如甲图所示,当反应达到平衡时,活塞位置如乙图所示。则当达到平衡时,A的转化率为 ;该条件下的反应的平衡常数为 。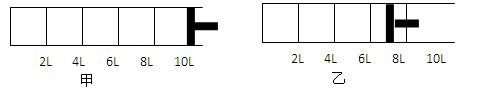
Ⅱ.(1)已知298K时,1molC2H6在氧气中完全燃烧生成二氧化碳和液态水,放出热量1558.3KJ。写出该反应的热化学方程式 。
(2)利用该反应可设计一个燃料电池:用氢氧化钾溶液做电解质溶液,用多孔石墨做电极,在电极上分别充入乙烷和氧气。写出负极的电极反应式 。
(3)用石墨做阳极,铁棒做阴极,电解硫酸铜溶液,则石墨棒上的电极反应式为 ;如果起始时盛有1000mL PH=5的硫酸铜溶液(25℃)(足量),一段时间后溶液的PH变为1,若要使溶液恢复到起始浓度(忽略溶液体积变化),可向溶液中加入 (填物质名称),其质量约为 。
一定温度下可逆反应:A(s)+2B(g)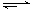 C(g)+D(g); △H<0。现将1 mol A和2 mol B加入甲容器中,将2 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍(如图所示,隔板K不能移动),t1时两容器内均达到平衡状态。下列说法正确的是
C(g)+D(g); △H<0。现将1 mol A和2 mol B加入甲容器中,将2 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍(如图所示,隔板K不能移动),t1时两容器内均达到平衡状态。下列说法正确的是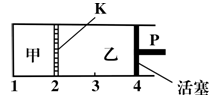
A.升高温度,达到新平衡后,甲中B的体积分数增大,乙中B的体积分数减小
B.将活塞由“4”推进到“3”,达到新平衡后,甲、乙两容器中C的百分含量相同
C.保持温度不变,向甲中再加入1 mol A和2 mol B,达到新平衡后,c(B)甲>2c(B)乙
D.保持温度和乙中压强不变,向乙中再加入2 mol D,达到新平衡后,c(B)乙≤2c(B)甲
工业上用CO生产燃料甲醇,一定条件下发生反应: CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
(1)图1是反应时CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)= 。
(2)图2表示该反应进行过程中能量的变化。曲线 (填“a”或“b”)表示不使用催化剂时反应的能量变化,不使用催化剂时该反应的逆反应的活化能为 。
(3)该反应平衡常数K的表达式为 ,温度升高,平衡常数K (填“增 大”、“不变”或“减小”)
大”、“不变”或“减小”)
(4)恒容条件下,下列措施中能使 增大的有 。
增大的有 。
| A.升高温度 | B.充入He气 |
| C.再充入1molCO和2molH2 | D.使用催化剂 |
(14分)(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行得越完全,K值大小与温度的关系是:温度升高,K值_______________(填“一定增大”“一定减小”或“可能增大也可能减小”)。
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在800℃时发生如下反应:
CO(g)+H2O (g) CO2(g)+H2 (g) △H<0
CO2(g)+H2 (g) △H<0
CO和H2O物质的量浓度变化如下图(a)所示,则:
① 0-4min间平均反应速率v(CO)=________ mol•L-1•min-1
②在800℃时该反应的化学平衡常数K=___________________________(要求写出表达式及数值);CO的转化率=______________。
图(a)
③在800℃时,若反应开始时此容器中CO和H2O的浓度分别为0.20 mol/L和0.80 mol/L,则达到平衡时CO转化为CO2的转化率是:______________________。
(3)25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是_______
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,c(Mg2+)后者大
B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小
C.25℃时,Mg(OH)2固体在20mL0.01mol·L-1氨水中的Ksp和在20mL0.01 mol·L-1
NH4Cl溶液中的Ksp相等
D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2可能转化为MgF2
E.25℃时,某饱和Mg(OH)2溶液中c(Mg2+)=0.0561mol·L-1,则溶液的pH=9
(4)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是 。
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.有效碰撞理论可指导怎样提高原料的转化率
C.勒夏特列原理可指导怎样使用有限原料多出产品
D.催化剂的使用是提高产品率的有效方法
E.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是_______________。
(2)一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5 (g)  4NO2 (g) + O2 (g) + Q (Q < 0 )
4NO2 (g) + O2 (g) + Q (Q < 0 )
①反应达到平衡后,若再通入一定量N2,则N2O5的转化率将________(填“增大”、“减小”或“不变”)
②下表为反应在T1温度下的部分实验数据:
| t/s |
0 |
500 |
1000 |
| C(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.48 |
则500s内N2O5的分解速率为_____________。
③在T2温度下,反应1000s时测得NO2的浓度为4.98mol/L,则T2______T1(填“>”、“<”或“=”)
(3)如图所示装置可用于制备N2O5,
则N2O5在电解池的_______区生成,
其电极反应式为_______________________。