开发利用清洁能源具有广阔的开发和应用前景,可减少污染解决雾霾问题。甲醇是一种可再生的清洁能源,一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g) CH3OH(g) ∆H ="-105" kJ·mol-1。向体积为2 L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如下左图中Ⅰ、Ⅱ、Ⅲ曲线所示:
CH3OH(g) ∆H ="-105" kJ·mol-1。向体积为2 L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如下左图中Ⅰ、Ⅱ、Ⅲ曲线所示:
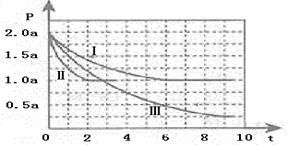
(1)①Ⅱ和Ⅰ相比,改变的反应条件是 。
②反应Ⅰ在6 min时达到平衡,在此条件下从反应开始到达到平衡时v (CH3OH) = 。
③反应Ⅱ在2 min时达到平衡,平衡常数K(Ⅱ)= 。在体积和温度不变的条件下,在上述反应达到平衡Ⅱ时,再往容器中加入1 mol CO和3 mol CH3OH后v(正)_______ v (逆)。(填“>”“<”“=”),原因是:_______________________。
④比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1 T3(填“>”“<”“=”),判断的理由是________________________。
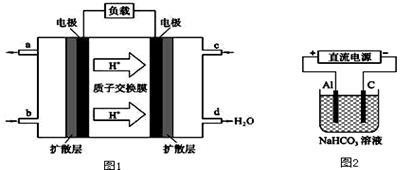
(2)某研究所组装的CH3OH﹣O2燃料电池的工作原理如图1所示。
①该电池负极的电极反应式为: 。
②以此电池作电源进行电解,装置如图2所示。发现溶液逐渐变浑浊并有气泡产生,其原因是 (用相关的离子方程式表示)。
雾霾严重影响人们的生活,汽车尾气排放是造成雾霾天气的重要原因之一.已知汽车尾气排放时容易发生以下反应:
①N2(g)+O2(g)⇌2NO(g)△H1="a" kJ•mol﹣1
②2NO(g)+O2(g)⇌2NO2(g)△H2="b" kJ•mol﹣1
③CO(g)+1/2O2(g)⇌CO2(g)△H3="c" kJ•mol﹣1
④2CO(g)+2NO(g)⇌N2(g)+2CO2(g)△H4
请回答下列问题:
(1)根据反应①②③,确定反应④中△H4 = kJ•mol﹣1。
(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应①的Kp= (用表达式表示).
(3)下列情况能说明反应②已达平衡状态的是 (填编号).
A.单位时间内生成1mol NO2的同时消耗了lmol NO
B.在恒温恒容的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,NO的体积分数保持不变
(4)探究反应④中NO的平衡转化率与压强、温度的关系,得到如图1所示的曲线.试分析实际化工生产中不采用高压的原因 。
(5)探究反应④中平衡时CO2的体积分数与反应物中 的比值、温度的关系,得到如图2所示的曲线。
的比值、温度的关系,得到如图2所示的曲线。
①在X、Y、Z三点中,CO的转化率从大到小的顺序是 。
②若保持其他条件不变,请在图2中,画出温度为T2(T2<T1)时的变化趋势曲线.
恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积为2L的密闭容器中,发生如下反应:N2+ 3H2 2NH3。
2NH3。
(1)若反应进行5min时,测得n(N2) = 1.8mol,n(NH3) = 0.4mol。
计算:①a的值; ②用H2浓度的变化表示的反应速率。
(2)反应达平衡时,混合气体的总物质的量为5.0mol,其中NH3的含量(体积分数)为40%。
计算:上述温度下该反应的化学平衡常数。
已知A(g)+B(g)  C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/ ℃ |
700 |
800 |
830 |
1000 |
1200 |
| 平衡常数 |
1.7 |
1.1 |
1 |
0.6 |
0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K= ,△H 0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)="0.003" mol·L-1·s-1,则6s时c(A)= mol·L-1, C的物质的量为 mol;若反应经一段时间后,达到平衡时A的转化率为 ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为 ;
(3)判断该反应是否达到平衡的依据为 (填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时问改变 d.单位时间里生成C和D的物质的量相等
(4)1200℃时反应C(g)+D(g)  A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含离子的化学组分及其浓度如下表:
| 离子 |
H+ |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/mol·L-1 |
未测定 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断试样的pH约为 。
(2)为减少SO2的排放,常采取的措施有:①将煤转化为清洁气体燃料。
已知:2H2(g)+O2(g)=2H2O(g) K1 2C(s)+O2(g)=2CO(g) K2
2C(s)+2H2O(g)=2CO(g)+2H2(g) K 则K=_____________(用含K1、K2的式子表示)。
②洗涤含SO2的烟气,以下物质可作洗涤剂的是 。
A.Ca(OH) 2 B.Na2CO3 C.CaCl2 D.NaHSO3
(3)汽车尾气中有NOx和CO的生成及转化,已知汽缸中生成NO的反应为:
N2 (g)+O2(g) 2NO(g) △H
2NO(g) △H 0
0
目前,在汽车尾气系统中装置催化转化器可减少CO和NOx的污染,其化学反应方程式为 。
工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应经过20分钟在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应经过20分钟在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为 计算:
计算:
(1)H2在20分钟内的平均反应速率为 ;
(2)该条件下N2的平衡转化率为 ;(小数点后保留一位)
(3)该条件下反应2NH3(g) N2(g)+3H2(g)的平衡常数为 。(不带单位)
N2(g)+3H2(g)的平衡常数为 。(不带单位)
汽车尾气中NO产生的反应为:N2(g)+O2(g) 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:
A.温度T下,该反应的平衡常数K=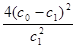 |
| B.温度T下,随着反应的进行,混合气体的密度减小 |
| C.曲线b对应的条件改变可能是加入了催化剂 |
| D.若曲线b对应的条件改变是温度,可判断该反应的△H<0 |
在容积固定的密闭容器中存在如下反应:N2(g)+3H2(g) 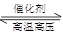 2NH3(g) ΔH<0。 某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出如下关系图。下列叙述正确的是( )
2NH3(g) ΔH<0。 某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出如下关系图。下列叙述正确的是( )
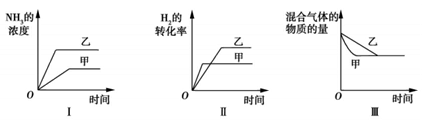
| A.图Ⅰ研究的是温度对反应的影响,且甲的温度比乙的高 |
| B.图Ⅱ研究的是温度对反应的影响,且甲的温度比乙的高 |
| C.图Ⅱ研究的是压强对反应的影响,且甲的压强比乙的大 |
| D.图Ⅲ研究的是不同催化剂对反应的影响,且乙使用的催化剂效率比甲使用的高 |
已知某可逆反应 mA(g)+ nB(g)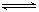 pC(g),在密闭容器中进行,下图表示在 不同反应时间 t、温度 T 和压强 P 与反应物 B 在混合气体中的百分含量 B%的关系曲线,由曲线分析,下列判断正确的是( )
pC(g),在密闭容器中进行,下图表示在 不同反应时间 t、温度 T 和压强 P 与反应物 B 在混合气体中的百分含量 B%的关系曲线,由曲线分析,下列判断正确的是( )

| A.T1<T2、P1>P2、m+n>p,△H <0; |
| B.T1>T2、P1<P2、m+n>p,△H >0; |
| C.T1>T2、P1<P2、m+n<p,△H >0; |
| D.T1<T2、P1>P2、m+n<p,△H <0; |
在体积不变的绝热密闭容器中,2molSO2与1molO2在催化剂作用下发生反应:2SO2(g)+ O2(g)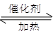 2SO3(g) △H=-QkJ/mol(Q>0)。当气体的物质的量减少0.5mol时反应达到平衡.下列叙述错误的是( )
2SO3(g) △H=-QkJ/mol(Q>0)。当气体的物质的量减少0.5mol时反应达到平衡.下列叙述错误的是( )
| A.增大氧气浓度,平衡正向移动,平衡常数不变 |
| B.降低温度,正反应速率比逆反应速率减小的程度小 |
| C.平衡时SO2气体的转化率为50% |
| D.该条件下反应放出0.5QkJ的热量 |
下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g)⇌CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g)⇌2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积减小的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动.
| A.①④ | B.①②③ | C.②③④ | D.①②③④ |
有效利用现有资源是解决能源问题的一种实际途径,发展“碳一化学”,开发利用我国相对丰富的煤炭资源具有重要的战略意义和经济价值。下面是以焦炭为原料,经“碳一化学”途径制取乙二醇的过程:

(1)以CO和CO2分别与H2为原料,在一定条件下均可合成甲醇(CH3OH)。你认为用哪种合成设计路线更符合“绿色化学”理念:(用化学反应方程式表示)____________;
(2)下图表示在恒容容器中230℃催化剂条件下,0.5molCO2和1.5molH2反应得到甲醇蒸气,产率达80%时的能量变化示意图。

①写出该反应的热化学方程式:_____________________。
②能判断该反应达到化学平衡状态的依据是_____________________。
a.容器中压强不变 b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中气体密度不变
(3)如图所示是用于合成甲醇产品中甲醇含量的检测仪。写出该仪器工作时的电极反应式:负极______。

(4)“催化还原”反应制乙二醇(HOCH2-CH2OH)原理如下:
CH3OOC-COOCH3(g)+4H2(g) HOCH2-CH2OH(g)+2CH3OH(g) △H=-34kJ/mol
HOCH2-CH2OH(g)+2CH3OH(g) △H=-34kJ/mol
为探究实际生产的最佳条件,某科研小组进行了多方面研究,下图表示乙二醇达平衡时的产率随原料投料比[n(氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线丙对应的压强时P(丙)=___________。

(5)草酸二甲酯水解产物草酸(H2C2O4)为二元中强酸。H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示曲线①代表的粒子是___________;草酸氢钾溶液中存在如下平衡:H2O H++OH-,HC2O4-
H++OH-,HC2O4- H++C2O42-和___________;一定温度下,往CaC2O4饱和溶液[已知Ksp(CaC2O4=2.3×10-9)]中加入少量CaCl2固体,c(Ca2+)将_________,CaC2O4的溶解度将____________。(填“增大”“减小”或“不变”)
H++C2O42-和___________;一定温度下,往CaC2O4饱和溶液[已知Ksp(CaC2O4=2.3×10-9)]中加入少量CaCl2固体,c(Ca2+)将_________,CaC2O4的溶解度将____________。(填“增大”“减小”或“不变”)

工业合成氨反应的能量变化如图所示。

(1)写出合成氨反应的热化学方程式:
(2)在甲乙两个体积均为2L固定容积的密闭容器中,分别充入甲:1molN2、3molH2和乙:1molN2、3molH2、1molHe,(其它条件相同),反应速率甲 乙(填大于、小于或等于),经过足够长的时间后在甲容器中该反应放出的热量(或吸收的热量) 92.4kJ(填“大于”、 “小于”或“等于”)
(3)下列图像分别代表焓变(△H )、混合气体平均相对分子质量(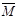 )、N2体积分数φ(N2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是 。
)、N2体积分数φ(N2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是 。

向2L密闭容器中加入1 mol NO和1 mol活性炭,发生反应:
2NO(g)+C(s) N2(g)+CO2(g) ΔH=﹣213.5 kJ/mol,达到平衡时数据如下:
N2(g)+CO2(g) ΔH=﹣213.5 kJ/mol,达到平衡时数据如下:
| 温度/℃ |
n(活性炭)/mol |
n(CO2)/mol |
| T1 |
0. 70 |
_______ |
| T2 |
_______ |
0.25 |
下列说法不正确的是
A.上述信息可推知:T1<T2
B.T1℃时,该反应的平衡常数K=9/16
C.T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小
D.T2℃时,若反应达平衡后再缩小容器的体积,c(N2)/c(NO)不变
当前我国环境状况不容乐观,其中PM2.5、CO、S02、NOx等污染物对空气质量的影响非常显著,其主要来源为燃煤、机动车尾气等,因此,对其进行研究具有重要意义。
(1)对某地PM2.5样本用蒸馏水处理后,测得该试样中的化学组分及其平均浓度如下表:

根据表中数据计算该试样的pH=
(2)NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化如图1所示。
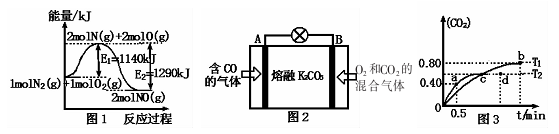
①写出N2和02反应的热化学方程式:________。
②有人设想将C0按下列反应除去:2CO(g)= 2C(s)+02(g)△H>O,请你分析该设想能否实现? (填“是”或“否”),依据是
③用图2所示原电池原理也可以除去CO,则其负极反应式为:________。
(3)有人设想利用反应NaOH+S02=NaHS03将SO2吸收除去,然后用石灰水又可使NaOH再生。再生的离子方程式为: 。
(4)利用I205消除CO污染的反应为:5CO(g)+I205(s)—兰5CO2(g)+I2(s),不同温度下,测得CO2的体积分数随时间t变化曲线如图3.则:
①该反应的化学平衡常数表达式为K=____ 。
②T1与T2化学平衡常数大小关系:K(T1)__________K(T2)(填“>”、“<”或“=”)