湖南省郴州市高三上学期12月教学质量监测理综化学试卷
化学与人类生产、生活、社会可持续发展密切相关,下列说法正确的是
| A.明矾净水的原理和家用消毒液消毒的原理相同 |
| B.在食品中科学使用食品添加剂,有利于提高人类生活质量 |
| C.“天宫一号”使用的碳纤维,是一种新型有机高分子材料 |
| D.工业上燃烧煤时,加入少量石灰石是为了减少CO2的排放 |
设NA为阿伏加德罗常数的值,下列说法正确的是
| A.lmolNa与足量的02反应生成Na20和Na2O2,失去的电子数为NA |
| B.标准状况下,44.8LHF所含分子数为2NA |
| C.在碳酸钠溶液中,若c(C032-) =lmol.L-1,则c(Na+)="2mol." L-l |
D.已知2SO2(g)+02(g)  2SO3(g);△H=-akJ.mol-l,将2NA个SO2与NA个02混合充分反应放出akJ的热量 2SO3(g);△H=-akJ.mol-l,将2NA个SO2与NA个02混合充分反应放出akJ的热量 |
下列离子方程式不正确的是
| A.向AgCl悬浊液中加入Na2S溶液:2AgCl+S2-=Ag2S+2C1- |
| B.向NaHCO3溶液中加入NaOH溶液:HC03一+OH-=C032-+ H20 |
| C.向Ba(OH)2溶液中加入稀H2S04:Ba2++ OH-+ H++ S042-=BaS04 ↓+H20 |
| D.向Cu粉中加入过量的浓HN03:Cu+4H++ 2N03-=Cu2++ 2N02 +2H20 |
关于右图所示化合物的说法正确的是
| A.分子中所有的原子共平面 |
| B.既可以与FeCl3溶液发生显色反应.又可以与NaHCO3溶液反应放出CO2气体 |
| C.1 mol该化合物最多可以与9mol H2发生加成反应 |
| D.该物质能发生取代反应、氧化反应、加成反应 |
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E、的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料,下列说法正确的是
A.元素A、B组成的化合物常温下一定呈气态
B.元素C、D、E的最高价氧化物对应的水化物两两之间能发生反应
C.工业上常用电解C、D的盐溶液来制备C、D元素的单质
D.化合物AE与CE有相同类型的化学键
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼( N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列关于该燃料电池的叙述不正确的是
| A.电流从右侧电极经过负载后流向左侧电极 |
| B.负极发生的电极反应式为:N2H4+4OH- - 4e-=N2+ 4H2O |
| C.该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 |
| D.该燃料电池持续放电时.K+从负极向正极迁移,因而离子交换膜需选用阳离子交换膜 |
某硅铁矿中主要含Si02、Fe304、Al203、Cu0。某工厂用它为原料进行综合应用来制取硅胶、铁红、铝、胆矾晶体,设计如下工业流程图:
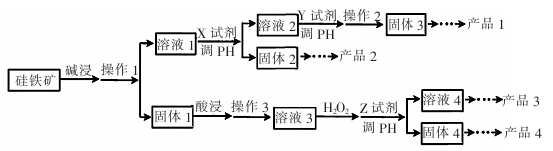
已知:Fe(OH)2、Fe(OH)3、Cu(OH)2完全沉淀的PH分别为9.6、3.7、9.4。
(1)碱浸时发生的离子反应方程式为:_
(2)为提高碱浸的浸出率,可采取的方法有 。(填两种即可)
(3)溶液3中加H2O2的目的是 。 对应的离子反应方程式为:________。
(4)Z试剂可以选用下列的 (填字母)
a. Cu b.CuO c.Cu(OH)2 d.CuCO3
(5)由溶液4制取产品3还要先加热到____(填字母)时,停止加热、冷却结晶。
| A.沸腾 |
| B.液体表面出现晶膜 |
| C.析出大量晶体 |
| D.快蒸干,还有少量液体 |
(6)判断固体4对应的元素沉淀完全的方法是:________________。
某同学查阅资料后设计了一条1-丁醇的合成路线:
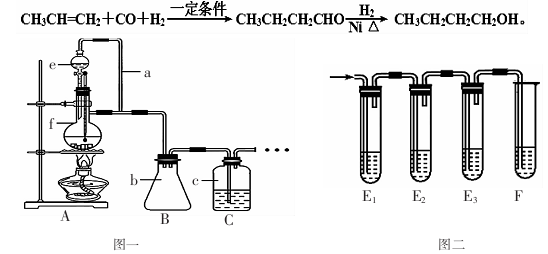
(1)利用图一装置可制备CO、丙烯等原料气体。①装置中e的名称是 ;
②a的作用 ;
(2)实验室常用浓硫酸与甲酸作用来制备CO。写出对应的化学方程式: 。
(3)制CO时,伴随的副产物还有少量S02、C02气体,某同学设计用图二装置进行检验。
①E1的作用是: ;E3的作用是: ;
②判断产物中有CO2的现象是
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是
| A.高温、常压、催化剂 | B.适当的温度、常压、催化剂 |
| C.低温、高压、催化剂 | D.适当的温度、高压、催化剂 |
(5)正丁醛经催化加氢得到含少量正丁醛的1一丁醇粗品,为提纯1-丁醇,该小组查阅文献得知:①R-CHO+NaHS03(饱和)→RCH(OH)S03Na ↓;②沸点:乙醚34℃,1-丁醇118℃。并设计出如下提纯路线:
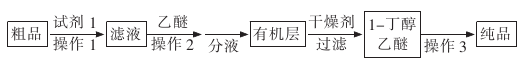
试剂1为 ,操作2为 ,操作3为
当前我国环境状况不容乐观,其中PM2.5、CO、S02、NOx等污染物对空气质量的影响非常显著,其主要来源为燃煤、机动车尾气等,因此,对其进行研究具有重要意义。
(1)对某地PM2.5样本用蒸馏水处理后,测得该试样中的化学组分及其平均浓度如下表:

根据表中数据计算该试样的pH=
(2)NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化如图1所示。
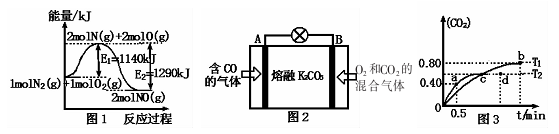
①写出N2和02反应的热化学方程式:________。
②有人设想将C0按下列反应除去:2CO(g)= 2C(s)+02(g)△H>O,请你分析该设想能否实现? (填“是”或“否”),依据是
③用图2所示原电池原理也可以除去CO,则其负极反应式为:________。
(3)有人设想利用反应NaOH+S02=NaHS03将SO2吸收除去,然后用石灰水又可使NaOH再生。再生的离子方程式为: 。
(4)利用I205消除CO污染的反应为:5CO(g)+I205(s)—兰5CO2(g)+I2(s),不同温度下,测得CO2的体积分数随时间t变化曲线如图3.则:
①该反应的化学平衡常数表达式为K=____ 。
②T1与T2化学平衡常数大小关系:K(T1)__________K(T2)(填“>”、“<”或“=”)
A是一种重要的食用香料,存在于玉米、葡萄等多种食品中。主要用于配制奶油、乳品、酸奶等香精,也可用于有机合成。以A为原料制备阴离子树脂M和新型聚酯材料N等的合成路线如图:

(1)B的结构简式为:____ 。
(2)反应I为加成反应,A中发生该反应的官能团的名称为:
(3)D与银氨溶液反应的化学方程式是:
(4)下列关于E的说法正确的是
a.能溶于水
b.能与H2发生还原反应
c.能发生氧化反应
d.能发生消去反应
(5)H→M的化学方程式是:
(6)F的结构简式为:____ 。
(7)A的属于酯类的同分异构体有 种,其中只含一个甲基的同分异构的结构简式是:___ _。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号