硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿(PbS)直接制备硫酸铅粉末的流程如下:

已知:(ⅰ)PbCl2(s)+2Cl-(aq) PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
(ⅱ)Ksp(PbSO4)=1.08×10-8, Ksp(PbCl2)=1.6×10-5
(ⅲ)Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的PH值分别为3.2、7.04
(1)步骤Ⅰ中生成PbCl2和S的离子方程式 ,加入盐酸的另一个目的是为了控制PH值在0.5~1.0,原因是 。
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因 。
(3)写出PbCl2晶体转化为PbSO4沉淀的离子方程式 。
(4)请用离子方程式解释加入H2O2后滤液2可循环利用的原因 ,滤液3是 。
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为 。
碳及其化合物有广泛的用途。
(1)反应C(s)+ H2O(g) CO(g)+H2(g) ΔH=" +131.3" kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
CO(g)+H2(g) ΔH=" +131.3" kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
| A.增加碳的用量 | B.升高温度 | C.用CO吸收剂除去CO | D.加入催化剂 |
(2)已知,C(s)+CO2(g) 2CO(g)△H=" +172.5" kJ•mol-1
2CO(g)△H=" +172.5" kJ•mol-1
则反应CO(g)+H2O(g) CO2(g)+H2(g) △H= ____________________。
CO2(g)+H2(g) △H= ____________________。
(3)CO与H2一定条件下反应生成甲醇(CH3OH),可利用甲醇设计一个燃料电池,用KOH溶液作电解质溶液,多孔石墨做电极,该电池负极反应式为______________________________。
(4)在一定温度下,将CO(g)和H2O(g)各0.16 mol分别通入到体积为2.0 L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)  CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:
| t / min |
2 |
4 |
7 |
9 |
| n(H2O)/mol |
0.12 |
0.11 |
0.10 |
0.10 |
1其它条件不变,降低温度,达到新平衡前 v(逆) _____ v(正) (填“>”、“<”或“=”) 。
2该温度下,此反应的平衡常数K=____________________________;
3其它条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数______(填“增大”、“减小”或“不变”)。
在一定温度下的可逆反应:mA(g)+nB(g) pC(g)+qD(g),生成物C的体积分数与压强p1和p2,时间t1和t2的关系如图所示,则在下列关系中正确的是
pC(g)+qD(g),生成物C的体积分数与压强p1和p2,时间t1和t2的关系如图所示,则在下列关系中正确的是
| A.p1>p2 | B.反应吸热 |
| C.m+n>p+q | D.m+n<p+q |
一定温度下,反应2SO2 + O2 2SO3,达到平衡时,n(SO2):n(O2):n(SO3)= 2:3:4。缩小体积,反应再次达到平衡时,n(O2)=0.8mol,n(SO3)=1.4mol,此时SO2的物质的量应是
2SO3,达到平衡时,n(SO2):n(O2):n(SO3)= 2:3:4。缩小体积,反应再次达到平衡时,n(O2)=0.8mol,n(SO3)=1.4mol,此时SO2的物质的量应是
| A.0.4mol | B.0.6mol | C.0.8mol | D.1.2mol |
在一定条件下,向一体积为2L的恒容密闭容器中充入2mol A,1mol B,发生如下反应:
2A(g)+B (? ) 3C(g) △H=-QkJ/mol(Q>0)。经过60s达到平衡,测得B物质的量为0.2mol,下列对该平衡的叙述正确的
3C(g) △H=-QkJ/mol(Q>0)。经过60s达到平衡,测得B物质的量为0.2mol,下列对该平衡的叙述正确的
| A.用C的浓度变化表示该反应速率为2.4mol/(L·min) |
| B.若使容器变为1L,则C的物质的量一定增大 |
| C.达到平衡,测得放出热量为x kJ,则x=Q |
| D.若向容器再充入1mol C,重新达平衡,A的体积分数保持不变,则B为气态 |
对可逆反应2A(s)+3B(g)  C(g)+2D(g)ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
C(g)+2D(g)ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
| A.①② | B.④ | C.③ | D.④⑤ |
在一定条件下的恒容密闭容器中发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g),图1表示反应过程中能量的变化,图2表示反应过程中物质浓度的变化。下列有关说法正确的是
CH3OH(g)+H2O(g),图1表示反应过程中能量的变化,图2表示反应过程中物质浓度的变化。下列有关说法正确的是
| A.该反应的焓变和熵变:ΔH>0,ΔS<0 |
| B.温度降低,该反应的平衡常数K增大 |
C.升高温度, 增大 增大 |
| D.从反应开始到平衡,用氢气表示的平均反应速率为2.25 mol/(L·min) |
已知CO(g)+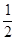 O2(g)=CO2(g),△H ="-283" kJ/mol;H2(g)+
O2(g)=CO2(g),△H ="-283" kJ/mol;H2(g)+ 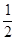 O2(g)=H2O(l),△H ="-285.8" kJ/mol;取CO和H2组成的混合气体0.5mol完全燃烧共放出142.34KJ的热量。若将此0.5mol混合气体充入密闭容器中置于900℃下发生 CO(g)+2 H2(g)
O2(g)=H2O(l),△H ="-285.8" kJ/mol;取CO和H2组成的混合气体0.5mol完全燃烧共放出142.34KJ的热量。若将此0.5mol混合气体充入密闭容器中置于900℃下发生 CO(g)+2 H2(g) CH3OH(g),在一定条件下达到平衡。平衡后容器内压强是相同条件下反应前压强的0.8倍,求:
CH3OH(g),在一定条件下达到平衡。平衡后容器内压强是相同条件下反应前压强的0.8倍,求:
(1)反应前混合气体中CO和H2的体积比;
(2)平衡混合气体中CH3OH和H2的物质的量;
(3)达到平衡时CO的转化率。
在一固定容积的密闭容器中,保持一定条件进行以下反应:X(g)+2Y(g)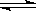 3Z(g),已知加2molX和3molY达到平衡后,生成amolZ。
3Z(g),已知加2molX和3molY达到平衡后,生成amolZ。
(1)在相同实验条件下,若在同一容器中改为加入4molX和6molY,达到平衡后,Z的物质的量为 mol。
(2)在相同实验条件下,若在同一容器中改为加入3molX和2molY,若要求在反应混合气体中Z体积分数不变,则还需加入Z mol。
(3)在相同实验条件下,若在同一容器中改为加入0.5molX,则需加 molY, mol Z,才能使平衡时Z为0.6amol。
对于平衡体系mA(g)+nB(g) 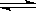 pC(g)+qD(g) 按题目的要求写出可能采取的措施。
pC(g)+qD(g) 按题目的要求写出可能采取的措施。
(1)正、逆反应速率都改变,但平衡不移动,则改变的条件可能是:① ,②若 ,则改变的条件是压强。
(2)只改变正反应速率或只改变逆反应速率,则改变的条件可能是单独改变 或是单独改变 。
(3)正、逆反应速率发生不同程度的变化,则改变的条件可能是:① ,②若 ,则改变的条件是压强。
在某一容积为5 L的密闭容器内,加入 0.2 mol的CO和0.2 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)  CO2(g)+H2(g),ΔH<0,反应中CO2的浓度随时间变化情况如右图:
CO2(g)+H2(g),ΔH<0,反应中CO2的浓度随时间变化情况如右图:
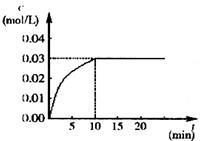
(1)根据图中数据计算反应开始至达到平衡时CO的化学反应速率为v(CO)= ;若升高温度,则化学平衡常数K (填“增大”“减小”或“不变”)。
(2)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.1 mol的CO2和0.1 mol的H2,在相同的条件下,反应CO(g)+H2O(g)  CO2(g)+H2(g)向 (填“正反应”或“逆反应”)方向进行,其依据是 。反应达平衡时,c(H2O)= 。
CO2(g)+H2(g)向 (填“正反应”或“逆反应”)方向进行,其依据是 。反应达平衡时,c(H2O)= 。
某体积可变的密闭容器中盛有适量的A和B的混合气体,在一定条件下发生反应,A(g) +3 B(g)  2 C(g)若维持温度和压强不变,达到平衡时,容器的体积为V L。其中C气体的体积占20%,下列推断正确的是
2 C(g)若维持温度和压强不变,达到平衡时,容器的体积为V L。其中C气体的体积占20%,下列推断正确的是
①原混合气体的体积为1.1V L ②原混合气体的体积为1.2V L
③反应达平衡时气体B消耗掉0.1V L ④反应达平衡时气体A消耗掉0.1V L
| A.②③ | B.②④ | C.①③ | D.①④ |
下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g)  CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应达平衡时,若减小反应器容积时平衡一定向气体体积增大的方向移动
④有气体参加的反应达平衡后,在恒压反应器中充入稀有气体,平衡一定不移动
| A.①④ | B.①②③ | C.②③④ | D.①②③④ |