下列事实不能用平衡移动原理来解释的是( )
| A.打开啤酒瓶盖,产生大量气泡 |
| B.稀释CH3COOH时,溶液中CH3COO—数目增多 |
| C.工业合成氨常用500℃左右的温度 |
| D.热的纯碱溶液的去污效果比冷的好 |
某化学反应中,反应混合物A、B、C的物质的量浓度(c)与时间(t)关系如下表所示:
| |
初始 |
2 min |
4 min |
6 min |
| c (A)(mol/L) |
1.45 |
1.28 |
1.00 |
1.00 |
| c (B)(mol/L) |
0.38 |
0.72 |
1.28 |
1.28 |
| c (C)(mol/L) |
0.095 |
0.18 |
0.32 |
0.32 |
下列说法正确的是( )
A.该反应的化学方程式为A = 2B+C
B.4 min末A的转化率约为31%
C.4~6min时,反应停止了
D.正反应是吸热反应
某温度下的定容密闭容器中,进行可逆反应:A(s)+2B(g)  C(g)+D(g),当下列物理量不发生变化时: ①混合气体的密度 ②容器内气体的压强 ③混合气体的平均相对分子质量 ④B的物质的量浓度 则能表明该反应一定已达到平衡状态的是( )
C(g)+D(g),当下列物理量不发生变化时: ①混合气体的密度 ②容器内气体的压强 ③混合气体的平均相对分子质量 ④B的物质的量浓度 则能表明该反应一定已达到平衡状态的是( )
| A.只有④ | B.②③ | C.②③④ | D.①③④ |
下列事实不能用勒夏特列原理来解释的是( )
| A.高压有利于氢气与氮气合成氨 |
| B.实验室中常用排饱和食盐水的方法收集Cl2 |
| C.用V2O5催化二氧化硫氧化为三氧化硫 |
| D.Cl2在水中的溶解度大于在饱和NaCl溶液中的溶解度 |
减少污染、保护环境是全世界最热门的课题。请回答下列问题:
(1)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:H2(g)+1/2O2(g)=H2O(g)  H= -241.8KJ/mol
H= -241.8KJ/mol
C(s)+1/2O2(g)=CO(g)  H= -110.5KJ/mol
H= -110.5KJ/mol
写出焦炭与水蒸气反应的热化学方程式 ;
②洗涤含SO2的烟气,以下物质可作洗涤剂的是 ;
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3、
(2)污染物CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
①在恒容体系中,可以判断反应达到平衡状态的依据是 (填序号).
a. v正(CH3OH)= v逆(CO) b.混合气体的密度不变
c. 混合气体的平均相对分子质量不变 d. c(CO):c(H2): c( CH3OH)= 1:2:1
②在密闭容器中充有10molCO与20molH2,CO的平衡转化率与温度、压强的关系如下图

M、N、Q三点的平衡常数KM、KN、KQ的大小关系为____ __。
(3)汽车尾气中NOx和CO的生成及转化为:
①已知气缸中生成NO的反应为:N2(g)+O2(g)  2NO(g)
2NO(g)  H>0
H>0
汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是 。
②若加入1mol空气(含有0.8molN2和0.2molO2),1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K(写出计算过程,计算过程中数据可作近似处理)
③汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g)  H>0,该设想能否实现? (选填“能”或“不能”),依据是 。
H>0,该设想能否实现? (选填“能”或“不能”),依据是 。
④ 目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为 。
将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。

①b<f;②915℃、2.0MPa时E的转化率为60%;③该反应的ΔS>0;④K(1000℃)>K(810℃)
上述①~④中正确的有( )
| A.4个 | B.3个 | C.2个 | D.1个 |
温度为T时;向2.0 L恒容密闭容器中充入1.0 mol PCl5;反应PCl5(g)  PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t/s |
0 |
50 |
150 |
250 |
350 |
| n(PCl3)/mol |
0 |
0.16 |
0. 19 |
0.20 |
0.20 |
下列说法正确的是( )
A.反应在前50 s的平均速率v(PCl3)="0.0032" mol·L-1·s-1
B.保持其他条件不变;升高温度;平衡时c(PCl3)="0.11" mol·L-1;则反应的ΔH<0
C.相同温度下;起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2;反应达到平衡前v(正)>v(逆)
D.相同温度下;起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2;达到平衡时;PCl3的转化率小于80%
化学中常用图像直观地描述化学反应的进程或结果。下列对图像的描述正确的是
A.根据图①可判断可逆反应A2(g)+3B2(g) 2AB3(g),正反应是吸热反应 2AB3(g),正反应是吸热反应 |
B.图②表示压强对反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大 3C(g)+D(s)的影响,乙的压强大 |
| C.图③可表示乙酸溶液中通入氨气至过量的过程中溶液导电性的变化 |
| D.根据图④可知,若除去CuSO4溶液中的Fe3+,可向溶液中加入CuO,调节pH在4~5之间即可 |
温度为t ℃,压强为1.01×106Pa的条件下,某密闭容器内,下列反应达到化学平衡:A(g)+B(g)  3C,测得此时c(A)=0.022 mol·L-1;压缩容器使压强增大到2.02×106 Pa,第二次达到平衡时,测得c(A)=0.05 mol·L-1;若继续压缩容器,使压强增大到4.04×107 Pa,第三次达到平衡时,测得c(A)=0.075 mol·L-1,则下列关于C物质状态的推测正确的是( )
3C,测得此时c(A)=0.022 mol·L-1;压缩容器使压强增大到2.02×106 Pa,第二次达到平衡时,测得c(A)=0.05 mol·L-1;若继续压缩容器,使压强增大到4.04×107 Pa,第三次达到平衡时,测得c(A)=0.075 mol·L-1,则下列关于C物质状态的推测正确的是( )
A.C为非气态 B.C为气态
C.第二次达到平衡时C为气态 D.第三次达到平衡时C为气态
在一个固定体积的密闭容器中,保持一定温度,进行以下反应:H2(g)+I2(g)  2HI(g)。已知起始时加入1 mol H2和2 mol I2(g),当达到平衡时H2的体积分数为φ。下列四种情况分别投入上述容器,且始终保持原温度,平衡时H2的体积分数也为φ的是( )
2HI(g)。已知起始时加入1 mol H2和2 mol I2(g),当达到平衡时H2的体积分数为φ。下列四种情况分别投入上述容器,且始终保持原温度,平衡时H2的体积分数也为φ的是( )
| A.2 mol H2(g)和1 mol I2(g) | B.3 mol HI(g) |
| C.2 mol H2(g)和2 mol I2(g) | D.1 mol I2(g)和2 mol HI(g) |
已知反应A2(g)+2B(s) A2B2(g) △H<0,下列说法正确的是( )
A2B2(g) △H<0,下列说法正确的是( )
| A.升高温度,化学平衡向正反应方向移动 |
| B.增大压强,正反应与逆反应速率均增大 |
| C.增大压强,化学平衡向正反应方向移动 |
| D.增大B的物质的量,化学平衡向正反应方向移动 |
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合如图的是( )
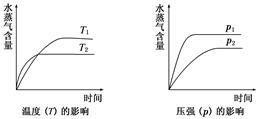
A.CO2(g)+2NH3(g) CO(NH2)2(s)+H2O(g)ΔH<0 CO(NH2)2(s)+H2O(g)ΔH<0 |
B.CO2(g)+H2(g) CO(g)+H2O(g)ΔH>0 CO(g)+H2O(g)ΔH>0 |
C.CH3CH2OH(g) CH2===CH2(g)+H2O(g)ΔH>0 CH2===CH2(g)+H2O(g)ΔH>0 |
| D.2C6H5CH2CH3(g)+O2(g)===2C6H5CH===CH2(g)+2H2O (g)ΔH<0 |
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 |
X |
Y |
Z |
| 初始浓度(mol·L-1) |
0.1 |
0.2 |
0 |
| 平衡浓度(mol·L-1) |
0.05 |
0.05 |
0.1 |
下列说法错误的是( )
A.反应达平衡时,X的转化率为50%
B.反应可表示为:X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
如图为PCl5(g) PCl3(g)+Cl2(g)(正反应为吸热反应)从平衡状态Ⅰ移动到平衡状态Ⅱ的反应速率(v)与时间(t)的曲线,此图表示的变化是 ( )
PCl3(g)+Cl2(g)(正反应为吸热反应)从平衡状态Ⅰ移动到平衡状态Ⅱ的反应速率(v)与时间(t)的曲线,此图表示的变化是 ( )

| A.降温 | B.降压 | C.增加PCl5的量 | D.增加PCl3的量 |