减少污染、保护环境是全世界最热门的课题。请回答下列问题:
(1)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:H2(g)+1/2O2(g)=H2O(g)  H= -241.8KJ/mol
H= -241.8KJ/mol
C(s)+1/2O2(g)=CO(g)  H= -110.5KJ/mol
H= -110.5KJ/mol
写出焦炭与水蒸气反应的热化学方程式 ;
②洗涤含SO2的烟气,以下物质可作洗涤剂的是 ;
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3、
(2)污染物CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
①在恒容体系中,可以判断反应达到平衡状态的依据是 (填序号).
a. v正(CH3OH)= v逆(CO) b.混合气体的密度不变
c. 混合气体的平均相对分子质量不变 d. c(CO):c(H2): c( CH3OH)= 1:2:1
②在密闭容器中充有10molCO与20molH2,CO的平衡转化率与温度、压强的关系如下图

M、N、Q三点的平衡常数KM、KN、KQ的大小关系为____ __。
(3)汽车尾气中NOx和CO的生成及转化为:
①已知气缸中生成NO的反应为:N2(g)+O2(g)  2NO(g)
2NO(g)  H>0
H>0
汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是 。
②若加入1mol空气(含有0.8molN2和0.2molO2),1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K(写出计算过程,计算过程中数据可作近似处理)
③汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g)  H>0,该设想能否实现? (选填“能”或“不能”),依据是 。
H>0,该设想能否实现? (选填“能”或“不能”),依据是 。
④ 目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为 。

 VOA2(有机层)+ H2SO4(水层),则步骤④中可选择硫酸作反萃取的原因是_____________。
VOA2(有机层)+ H2SO4(水层),则步骤④中可选择硫酸作反萃取的原因是_____________。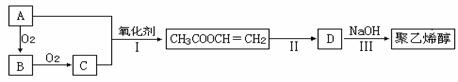

 粤公网安备 44130202000953号
粤公网安备 44130202000953号