(15分)利用LiOH和钴氧化物可制备锂离子电池正极材料。LiOH可由电解法制备,钴氧化物可通过处理钴渣获得。
(1)利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为__________溶液(填化学式),阳极电极反应式为__________ ,电解过程中Li+向_____电极迁移(填“A”或“B”)。
(2)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:
Co(OH)3溶解还原反应的离子方程式为____________________________________,铁渣中铁元素的化合价为___________,在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为__________。
工业制硫酸生产流程如下图: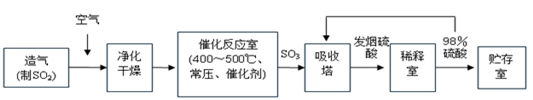
已知:在450℃,常压下,2SO2(g)+O2(g)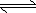 2SO3(g),ΔH=-196 kJ·mol-1。请回答:
2SO3(g),ΔH=-196 kJ·mol-1。请回答:
(1)在催化反应室,下列措施中有利于提高SO2平衡转化率的有 ;
A.升高温度 B.减少压强 C.不断补充空气 D.及时分离出SO3
(2)在生产中,为提高催化剂效率可采取的措施为 ;
A.净化气体 B.控制温度在400~500℃
C.增大催化剂与反应气体的接触面积 D.不断补充空气
(3)在450℃、常压和钒催化条件下向一密闭容器中充入2molSO2和1molO2,充分反应后,放出的热量______(填“<”、“>”或“=”)196kJ。
(4)经检测生产硫酸的原料气成分(体积分数)为SO27%、O211%、N282%。在500℃,0.1MPa条件下,现有100L原料气参加反应,达到平衡时,气体的总体积变为97.2L,则SO2的转化率为 。
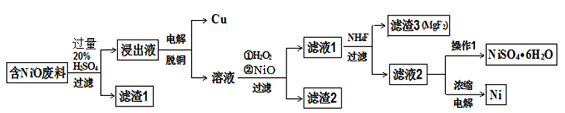
某NiO的废料中有FeO、CuO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4和Ni的流程如下:
已知:有关金属离子生成氢氧化物沉淀所需的pH如下表:
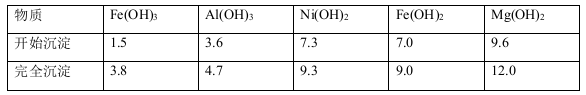
(1)滤渣1的主要成分为 。
(2)从滤液2中获得NiSO4.6H2O的实验操作 、 、过滤、洗涤、干燥。
(3)用离子方程式解释加入H2O2的作用 。
(4)加NiO调节溶液的pH至5,则生成沉淀的离子方程式有 。
(5)电解浓缩后的滤液2可获得金属镍,其基本反应原理如图:
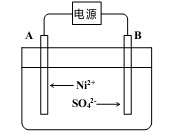
①A电极反应式为 和2H++2e- =H2↑。
②若一段时间后,在A、B两极均收集到11.2L气体(标准状况下),能得到Ni g。
水是重要的自然资源,与人类的发展密切相关。
(1)25℃时,水能按下列方式电离:
H2O+H2O H3O++OH- K1=1.0×10-14
H3O++OH- K1=1.0×10-14
OH-+H2O H3O++O2- K2=1.0×10-36
H3O++O2- K2=1.0×10-36
水中c(O2-) = mol·L-1(填数值)。
(2)水广泛应用于化学反应。将干燥的碘粉与铝粉混合未见反应,滴加一滴水后升起紫色的碘蒸气,最后得到白色固体。有关该实验的解释合理的是 。
| A.加水使碘和铝粉形成溶液 | B.水作氧化剂 |
| C.碘粉与铝粉反应是放热反应 | D.水作催化剂 |
(3)铁酸铜(CuFe2O4)是很有前景的热化学循环分解水制氢的材料。
ⅰ.某课外小组制备铁酸铜(CuFe2O4)的流程如下: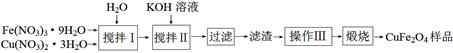
搅拌Ⅰ所得溶液中Fe(NO3)3、Cu(NO3)2的物质的量浓度分别为2.6 mol·L-1、 1.3 mol·L-1。
①搅拌Ⅰ所得溶液中Fe元素的存在形式有Fe3+和 (填化学式)。
②搅拌Ⅱ要跟踪操作过程的pH变化。在滴加KOH溶液至pH=4的过程中(假设溶液体积不变),小组同学绘制溶液中c(Fe3+)、c(Cu2+)随pH变化的曲线如下图,其中正确的是 (用“A”、“B”填空)。
(已知:Ksp[Fe(OH)3]=2.6×10-39、Ksp[Cu(OH)2]=2.2×10-20)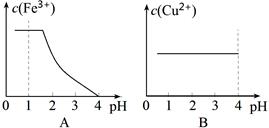
③操作Ⅲ为 、 。
ⅱ.在热化学循环分解水制氢的过程中,铁酸铜(CuFe2O4)先要煅烧成氧缺位体(CuFe2O4-a),氧缺位值(a)越大,活性越高,制氢越容易。
④氧缺位体与水反应制氢的化学方程式为 。
⑤课外小组将铁酸铜样品在N2的气氛中充分煅烧,得氧缺位体的质量为原质量的96.6%,则氧缺位值(a)= 。
(一) 尿素又称碳酰胺,是含氮量最高的氮肥,工业上利用二氧化碳和氨气在一定条件下合成尿素。其反应分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸铵)(l) △H1= -330.0 kJ·mol-1
H2NCOONH4(氨基甲酸铵)(l) △H1= -330.0 kJ·mol-1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l) △H2=" +" 226.3 kJ·mol-1
H2O(l)+H2NCONH2(l) △H2=" +" 226.3 kJ·mol-1
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 m3 密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 步反应决定。
②反应进行到10 min时测得CO2的物质的量如上图所示,则用CO2表示的第一步反应的速率v(CO2)= mol/(L·min)。
③当反应在一定条件下达到平衡,若在恒温、恒容下再充入一定量气体He,则CO(NH2)2(l)的质量_________(填“增加”、“减小”或“不变”)。
(二)氨是制备尿素的原料,NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
氨气溶于水得到氨水,在25℃下,将amol/L的氨水与bmol/L的硫酸以3∶2体积比混合反应后溶液呈中性。用含a和b的代数式表示出氨水的电离平衡常数为_________。
(三)氢气是合成氨的原料。“氢能”将是未来最理想的新能源。
(1)在25℃,101KPa条件下,1 g氢气完全燃烧生成液态水时放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为 。
(2)氢气通常用生产水煤气的方法制得。其中C(s)+ H2O(g) CO(g)+H2(g),在850℃时平衡常数K=1。若向1升的恒定密闭真空容器中同时加入x mol C和6.0mol H2O。
CO(g)+H2(g),在850℃时平衡常数K=1。若向1升的恒定密闭真空容器中同时加入x mol C和6.0mol H2O。
①当加热到850℃反应达到平衡的标志有______________ 。
| A.容器内的压强不变 |
| B.消耗水蒸气的物质的量与生成CO的物质的量相等 |
| C.混合气的密度不变 |
| D.单位时间有n个H-O键断裂的同时有n个H-H键断裂 |
②x应满足的条件是 。
(四)CO2是合成尿素的原料,但水泥厂生产时却排放出大量的CO2。华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示: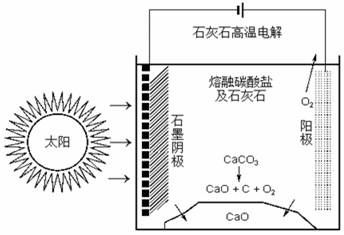
(1)上述生产过程的能量转化方式是 。
(2)上述电解反应在温度小于900℃时进行碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,则阳极的电极反应式为 ,阴极的电极反应式为 。
(原创)三聚氰胺(化学式:C3N6H6)是一种重要有机化工原料。下图是我国科技工作者研制的以尿素为原料生产三聚氰胺的工艺——“常压气相一步法联产纯碱新技术”: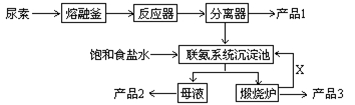
已知:以尿素为原料生产三聚氰胺的原理是:6 CO(NH2)2 C3N6H6 +6 NH3+3CO2
C3N6H6 +6 NH3+3CO2
请回答:
(1)尿素的结构式为
(2)已知:产品1是本工艺的主产品,产品2是副产品,X为循环使用的物质,产品3为纯碱。写出各主要成份的化学式:产品1 产品2 X
(3)联氨系统沉淀池中发生的化学反应方程式为:
(4)为了使母液中析出更多的产品2 ,常用的方法是
| A.加入固体NaCl | B.加入固体NaHCO3 |
| C.通入CO2气体 | D.通入NH3 |
(5)若生产过程中有4%的尿素损耗,每吨尿素理论上可得副产品纯碱 吨(精确到0.001)
按要求完成下列问题:
(1)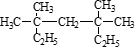 系统命名法为____________________ ,
系统命名法为____________________ ,
(2)4―甲基―1―戊烯的键线式为 __________________________ ,
(3)写出乙醛与新制氢氧化铜反应化学方程式 ____________________________________,
(4)下列有关实验的说法不正确的是_____________。
| A.制乙烯时,温度计应插入反应混合液中 |
| B.检验C2H5Cl中氯元素时,将C2H5Cl和NaOH水溶液混合加热,然后用稀硫酸酸化,再加入AgNO3溶液 |
| C.做过银镜反应的试管用氨水洗涤,做过苯酚的试管用酒精洗涤 |
| D.将一定量CuSO4和NaOH溶液混合后加入甲醛溶液,加热未产生砖红色沉淀,原因可能是NaOH量太少 |
I.下列说法中正确的是_________。
A.制作航天服的聚脂纤维是新型无机非金属材料
B.肥皂可以用来去油污
C.金属的腐蚀属于物理变化
D.煤的气化属于化学变化
II.如图是找国科技工作者研制的以尿素为原料生产三聚氰胺(C3N6H6)的工艺——“常压气相一步法联产纯玻新技术”:
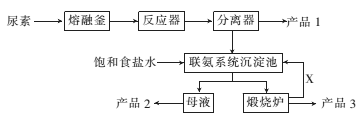
已知:①尿素的熔点是132.7℃ ,常压下超过160℃即可分解;②三聚氰胺的熔点是354℃,加热易升华,微溶于水。
请回答下列问题:
(1)以尿素为原料生产三聚氮胺的原理:____CO(NH2)2 ______C3N6H6+___NH3↑+__CO2↑
______C3N6H6+___NH3↑+__CO2↑
(配平化学方程式,在横线上填上相应物质的化学计量数),在实验室使尿素熔化的容器的名称为________。
(2)写出下列物质中主要成分的化学式:产品2_____、X_____ 。
(3)联氨系统沉淀池中发生反应的化学方程式为____________。
(4)为了使母液中析出更多的产品2,常用的方法是________。
A.加人NaOH固体 B.加入NaHCO3固体 C.通人CO2 D.通入NH3
(NH4)2Fe(SO4)2俗称莫尔盐,其常见的制备工艺流程如下: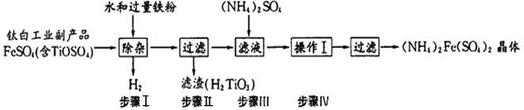
(1)已知流程中铁粉制备反应如下:
4 H2O(g) +3Fe(s) Fe3O4(s)十4H2(g) △H ="a" kJ /mol
Fe3O4(s)十4H2(g) △H ="a" kJ /mol
Fe3O4(s) =" 3" Fe(s)+ 2O2(g) △H ="b" kJ/mol
则光解气态水制备H2的热化学方程式为 。
(2)步骤I中加水发生如下反应,请完善该反应: +2H2O  2H++ H2TiO3 ↓;
2H++ H2TiO3 ↓;
该步骤加入铁粉的作用是① ;② 。
(3)步骤Ⅳ生成(NH4)2Fe(SO4)2,其化学反应方程式为 ;
写出(NH4)2Fe(SO4)2溶液中各离子溶度由大到小的顺序:
(4)已知在潮湿空气中Fe(OH)2比FeCl2更易被氧化。据此分析(NH4)2Fe(SO4)2比FeSO4稳定的原因是 。
(5)室温时Fe(OH)3的悬浊液中存在Fe(OH)3(s) Fe3+(aq)+3OH-(aq) Ksp[Fe(OH)3] =8ⅹ10-32若此悬浊液中 c(Fe3+)="0.08" mol·L-1则溶液的pH等于 。
Fe3+(aq)+3OH-(aq) Ksp[Fe(OH)3] =8ⅹ10-32若此悬浊液中 c(Fe3+)="0.08" mol·L-1则溶液的pH等于 。
由钛铁矿(主要成分是TiO2、少量FeO和Fe2O3)制备TiCl4、绿矾等产品的一种综合工艺流程图如下: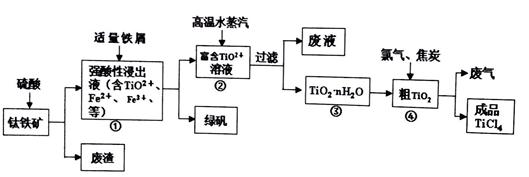
【提示】TiO2+的水解平衡TiO2++(n+1)H2O TiO2.n H2O+2H+
TiO2.n H2O+2H+
回答下列问题:
(1)硫酸与二氧化钛反应的离子方程式是 。
(2)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH =+140 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH =-221kJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式: 。
(3)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生。
A:2Fe3++Fe=3Fe2+
B:2 TiO2+(无色) +Fe+4H+=2Ti3+(紫色)+ Fe2++2H2O
C:Ti3+(紫色)+ Fe3++H2O=TiO2+(无色) +Fe2++2H+
I.结合信息判断Fe3+、TiO2+、 H+氧化性强弱: > >
II.加入铁屑的作用是 。
(4)往②中不断通入高温水蒸气,维持溶液沸腾一段时间,析出水合二氧化钛沉淀。
请用化学平衡理论分析通入高温水蒸气的作用: 。
(5)依据绿色化学理念,该工艺流程中存在的不足之处是 (只要求写出一项)。
(6)绿矾(摩尔质量为278g/mol)可用于生产红色颜料(Fe2O3),556akg绿矾,理论上可生产红色颜料___mol。
硝酸铝[Al(NO3)3]是一种常用媒染剂。工业上用铝灰(主要含Al、Al2O3、Fe2O3等)制取硝酸铝晶体[Al(NO3)3·9H2O]的流程如下: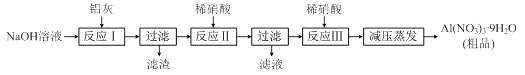
(1)写出反应Ⅰ的离子方程式: (任写一个)。
(2)若在实验室中完成反应Ⅱ,为避免铝的损失,需要解决的问题是 ,可采取的措施为 。
(3)上述流程中采用减压蒸发,并控制反应Ⅲ中加入的稀硝酸稍过量,其目的是 。
(4)温度高于200℃时,硝酸铝完全分解成氧化铝和两种气体(其体积比为4:1),该反应的化学方程式是 。
(5)若用下图所示实验装置制取Al(NO3)3,通入水蒸气的作用是 。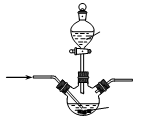
(16分)用芒硝(Na2SO4·10H2O)制备纯碱、铵明矾[NH4Al(SO4)2·12H2O]的生产工艺流程图如下所示:
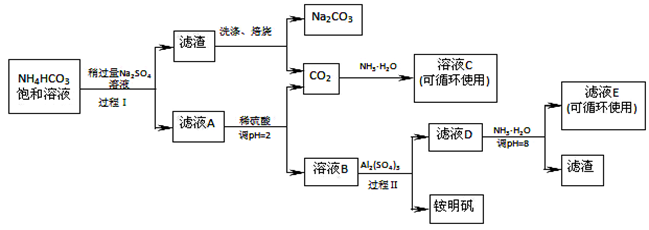
(1)溶液C中的溶质主要是 。
(2)铵明矾的溶液呈 性,铵明矾可用于净水,用离子方程式说明原理 。
(3)过程Ⅰ反应温度不能超过40℃,主要原因是 。
(4)运用化学平衡原理解释Na2SO4溶液稍过量的原因
(5)滤液E中溶质离子为
(6)写出工艺流程中焙烧的反应方程式
某煤渣主要含有Al2O3、SiO2,可制备碱式硫酸铝[Al2(SO4)3·2Al(OH)3]溶液,用于烟气脱硫,减少SO2的排放,其制备流程:
已知:25℃,Ksp(CaCO3)=2.8×10-9, Ksp(CaSO4)=9.1×10-6。
(1)操作①的名称 。
(2)酸浸时反应的离子方程式为 ;为了提高酸浸时铝元素的浸出率,可采取的措施____________________,___________________(写2条)。
(3)固体2的化学式是 ,试分析固体2生成的主要原因(用离子方程式结合文字简要说明) 。
(4)碱式硫酸铝溶液吸收SO2生成Al2(SO4)3·Al2(SO3)3,再向该溶液通入足量空气,生成一种硫酸盐,用于制备碱式硫酸铝溶液的循环使用,试写出有关反应的化学方程式: , 。
硼氢化钠()在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠NaBO2为主要原料制备
,其流程如下:
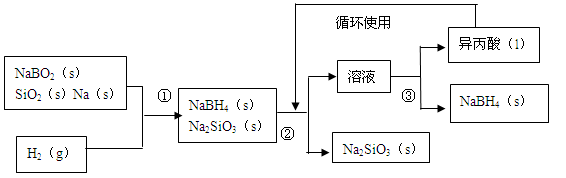
已知:常温下能与水反应,可溶于异丙酸(沸点:13℃)。
(1)在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,该操作的目的是,原料中的金属钠通常保存在中,实验室取用少量金属钠需要用到的实验用品有,,玻璃片和小刀等。
(2)请配平第①步反应的化学方程式:
+□
+□
+□
==□
+□
(3)第②步分离采用的方法是;第③步分离()并回收溶剂,采用的方法是。
(4)与水反应生成
和氢气,在25℃,101
下,已知每消耗3.8克
放热21.6
,该反应的热化学方程式是。
制备多晶硅(硅单质的一种)的副产物以SiCl4为主,其对环境污染很大,遇水强烈水解,放出大量热量。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成份为BaCO3,含有钙、铁、镁等离子)制备BaCl2·2H2O,流程为:
已知常温下Fe3+、Mg2+完全沉淀的pH分别是3.4和12.4;
(1)①SiCl4水解控制在40℃以下的原因是 。
②已知:SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g) ΔH1=47 kJ/mol
SiHCl3(s)+H2(g)=Si(s)+3HCl(g) ΔH2=189 kJ/mol
则SiCl4被H2还原制备硅的热化学方程式 。
(2)加钡矿粉时生成BaCl2的离子反应方程式 。
(3)过滤②的滤渣A的成分化学式为 ;接着往滤液中加20% NaOH调节pH=12.5,控制温度70℃时,滤渣B的主要成分的化学式 ,控制温度70℃的目的 。
(4)滤液③经 、过滤等操作,再经真空干燥后得到BaCl2·2H2O。