2015年全国统一高考理综试卷(安徽卷)化学部分
碳酸亚乙酯是锂离子电池低温电解液的重要添加剂,其结构如下图。下列有关该物质的说法正确的是

| A. | 分子式为 |
| B. | 分子中含6个 键 |
| C. | 分子中只有极性键 |
| D. | 8.6 该物质完全燃烧得到6.72 |
下列有关实验的选项正确的是
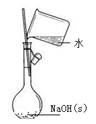
| .配制0.10 溶液 |
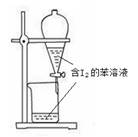
.除去中的 | .苯萃取碘水中的分出水层后的操作 |
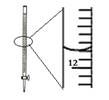
.记录滴定终点读数为12.20 |
 |
 |
 |
 |
下列有关说法正确的是
| A. | 在酒精灯加热条件下, 、 固体都能发生分解 |
| B. | 胶体无色、透明,能发生丁达尔现象 |
| C. | O 三种气体都可用浓硫酸干燥 |
| D. | 既能和氢氧化钠溶液反应也能和氢氟酸反应,所以是两性氧化物 |
下列有关和混合溶液的叙述正确的是
| A. | 该溶液中, 、 、 、 可以大量共存 |
| B. | 该溶液中, 、 、 、 可以大量共存 |
| C. | 向该溶液中滴入少量 溶液,反应的离子方程式为: |
| D. | 向该溶液中加入浓盐酸,每产生1 ,转移电子约为6.02×10 23个 |
汽车尾气中,产生NO的反应为:
 ,一定条件下,等物质的量的
和
在恒容密闭容器中反应,下图曲线
表示该反应在温度
下
的浓度随时间的变化,曲线
表示该反应在某一起始条件改变时
的浓度随时间的变化。下列叙述正确的是( )
,一定条件下,等物质的量的
和
在恒容密闭容器中反应,下图曲线
表示该反应在温度
下
的浓度随时间的变化,曲线
表示该反应在某一起始条件改变时
的浓度随时间的变化。下列叙述正确的是( )
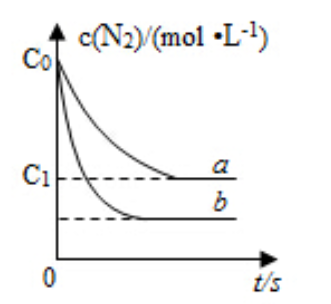
| A. | 温度 下,该反应的平衡常数 |
| B. | 温度 下,随着反应的进行,混合气体的密度减小 |
| C. | 曲线 对应的条件改变可能是加入了催化剂 |
| D. | 若曲线 对应的条件改变是温度,可判断该反应的 |
某同学将光亮的镁条放入盛有NH4Cl溶液的试管中,有大量气泡产生。为探究该反应原理,该同学做了以下试验并观察到相关现象,由此得出的结论不合理的是()
| 选项 |
实验及现象 |
结论 |
| A |
将湿润的红色石蕊试纸放在试管口,试纸变蓝 |
反应中有产生 |
| B |
收集产生的气体并点燃,火焰呈淡蓝色 |
反应中有产生 |
| C |
收集气体的同时测得溶液的pH为8.0 |
弱碱性溶液中也可被氧化 |
| D |
将光亮的镁条放入pH为8.6的NaHCO3溶液中,有气泡产生 |
弱碱性溶液中氧化了 |
25℃时,在10浓度均为0.1和混合溶液中,滴加0.1的盐酸,下列有关溶液中粒子浓度关系正确的是
| A. | 未加盐酸时: |
| B. | 加入10 盐酸时: |
| C. | 加入盐酸至溶液 =7时: |
| D. | 加入20 盐酸时: |
是常见的六种元素。
(1)
位于元素周期表第周期第族。
(2)
的基态原子核外电子排布式为;
的基态原子最外层有个电子。
(3)用">"或"<"填空:
| 原子半径 |
电负性 |
熔点 |
沸点 |
| 金刚石晶体硅 |
|
(4)常温下,将除去表面氧化膜的
、
片插入浓
中组成原电池(图1),测得原电池的电流强度(
)随时间(
)的变化如图2所示,反应过程中有红棕色气体产生。
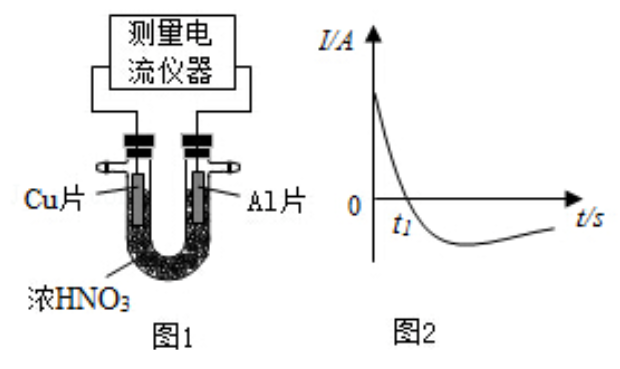
0- 时,原电池的负极是 片,此时,正极的电极反应式是,溶液中的 向极移动, 时,原电池中电子流动方向发生改变,其原因是。
(15分)四苯基乙烯()及其衍生物具有诱导发光特性,在光电材料等领域应用前景广泛。以下是TFE的两条合成路线(部分试剂及反应条件省略):

(1)的名称是;试剂为。
(2)的反应类型为;中官能团的名称是,中官能团的名称是.。
(3)的化学方程式是。
(4)是的同分异构体,具有下列结构特征:①属于萘( )的一元取代物;②存在羟甲基()。写出W所有可能的结构简式:。
)的一元取代物;②存在羟甲基()。写出W所有可能的结构简式:。
(5)下列叙述正确的是。
a.的酸性比苯酚强 b.不能发生还原反应
c.含有3种不同化学环境的氢 d.既属于芳香烃也属于烯烃
硼氢化钠()在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠NaBO2为主要原料制备,其流程如下:
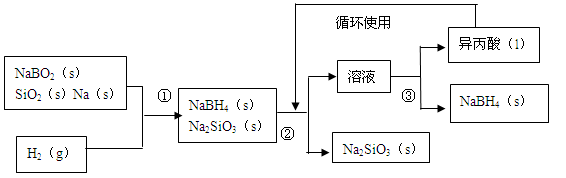
已知:常温下能与水反应,可溶于异丙酸(沸点:13℃)。
(1)在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,该操作的目的是
(2)请配平第①步反应的化学方程式:
+□+□+□==□+□
(3)第②步分离采用的方法是
(4)与水反应生成和氢气,在25℃,101下,已知每消耗3.8克放热21.6,该反应的热化学方程式是
某研究小组将纯净的气体通入0.1的溶液中,得到了沉淀,为探究上述溶液中何种微粒能氧化通入的,该小组突出了如下假设:
假设一:溶液中的
假设二:溶液中溶解的
(1)验证假设一
该小组涉及实验验证了假设一,请在下表空白处填写相关实验现象
| 实验步骤 |
实验现象 |
结论 |
| 实验1:在盛有不含的250.1溶液的烧杯中,缓慢通入纯净的气体 |
假设一成立 |
|
| 实验2:在盛有不含的250.1溶液的烧杯中,缓慢通入纯净的气体 |
(2)为深入研究该反应,该小组还测得上述两个实验中溶液的随通入积的变化曲线入下图

实验1中溶液变小的原因是;时,实验2中溶液小于实验1的原因是(用离子方程式表示)。
(3)验证假设二
请设计实验验证假设二,写出实验步骤,预期现象和结论。
| 实验步骤、预期现象和结论(不要求写具体操作过程) |
(4)若假设二成立,请预测:在相同条件下,分别通入足量的和,氧化相同的溶液(溶液体积变化忽略不计),充分反映后两溶液的前者(填大于或小于)后者,理由是
 粤公网安备 44130202000953号
粤公网安备 44130202000953号