实验题
(1)右图为实验室制备乙烯的装置图,请回答:

Ⅰ烧瓶中加入的两种试剂是 。
Ⅱ写出实验室制乙烯的化学方程式:______________________。
Ⅲ实验室收集乙烯应采用_____________法。
(2)某同学欲用12mol/L的浓盐酸配制1mol/L的盐酸250mL。
Ⅰ操作时,必须用到的仪器是 _________________(填序号)。
①500mL容量瓶 ②250mL容量瓶 ③100mL烧杯 ④50mL量筒 ⑤10mL量筒
Ⅱ操作中,将洗涤烧杯后的洗液也注入容量瓶,其目的是 。
Ⅲ用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,处理的方法是_____________(填序号)。
①吸出多余液体,使凹液面与刻度线相切
②小心加热容量瓶,经蒸发后,使凹液面与刻度线相切
③经计算加入一定量的浓盐酸
④重新配制
(3)为测定由CO、NH3、CO2、H2组成的混合气体中各成分的体积分数,请用下列装置设计一个简单实验(装置不能重复使用,所用试剂均过量)。
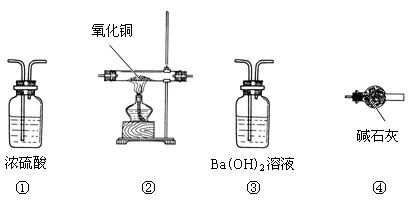
已知存在下列反应:2NH3 +3 CuO  3Cu + N2 + 3H2O
3Cu + N2 + 3H2O
请回答:
Ⅰ混合气体通过各装置的顺序依次是( )→( ① )→( )→( );
Ⅱ写出装置③中有关反应的离子方程式 ;
Ⅲ装置③和④的位置不可互换,其原因是 。
CH3Cl为无色,略带臭味的气体,密度为2.25g/L,熔点为-24.2℃,20℃时在水中的溶解度为400mL,易溶于乙醇和丙醇等有机溶剂。
Ⅰ.实验室制取CH3Cl的原理是CH3OH +HCl(浓) CH3Cl+H2O。具体步骤如下:
CH3Cl+H2O。具体步骤如下:

①干燥ZnCl2晶体;
②称取24g研细的无水ZnCl2和量取20mL浓盐酸放入圆底烧瓶,同时量取一定量的甲醇放入分液漏斗中;
③将分液漏斗里的甲醇逐滴滴入烧瓶中并加热,待ZnCl2完全溶解后有CH3Cl气体逸出,可用排水法收集。请回答:
(1)实验室干燥ZnCl2晶体制得无水ZnCl2的方法是 。
(2)反应过程中滴入烧瓶中甲醇的体积比盐酸少(甲醇与浓盐酸的物质的量浓度接近)
其理由是 。
(3)实验室为何用排水法收集CH3Cl?
Ⅱ.据某资料记载,CH4分子中的一个H原子被Cl原子取代后,其稳定性受到影响,可被强氧化剂酸性高锰酸钾氧化。现有四只洗气瓶;分别盛有以下试剂:
| A.1.5%KMnO4(H+)溶液 | B.蒸馏水 |
| C.5%Na2SO3溶液 | D.98%H2SO4 |
(1)为证实这一理论的可靠性,请从上面选择最恰当的洗气瓶,将a装置生成的气体依次通过洗气瓶
(填洗气瓶编号),如果观察到 则证实上述资料的正确性。
(2)写出洗气瓶中发生反应的离子方程式(C元素的氧化产物为CO2):
(3)如果CH3Cl是大气的污染物,上述洗气瓶之后还应接一只盛 的洗气瓶。
硫酸亚铁铵又称莫尔盐,是浅绿色晶体。它在空气中比一般亚铁盐稳定,是常用的Fe2+试剂。某实验小组利用工业废铁屑制取莫尔盐,并测定其组成,他们进行了以下实验。
Ⅰ.莫尔盐的制取,请回答下列问题。

(1)废铁屑中含氧化铁,无需在制备前除去,理由是________________、_______________(用离子方程式回答),实验前都需将废铁屑放入碳酸钠溶液中煮沸,倾倒出液体,用水洗净铁屑。从以下仪器中选择组装,完成该操作必需的仪器有__________(填编号)。
①铁架台 ②玻璃棒 ③广口瓶 ④石棉网 ⑤烧杯 ⑥漏斗 ⑦酒精灯
(2)步骤2中加热方式 (填“直接加热”﹑“水浴加热”或“沙浴”);必须在铁屑少量剩余时,进行热过滤,其原因是
II.莫尔盐组成的测定
①将摩尔盐低温烘干后,称取7.84 g加热至100℃失去结晶水,质量变为5.68 g。
②选择下图所示的部分装置连接起来,检查气密性后,将上述5.68g固体放入A装置的锥形瓶中,再向锥形瓶中加入足量NaOH浓溶液,充分吸收产生的气体并测出气体质量为0.68 g。
③向A中加入适量3%的H 2 O 2溶液,充分振荡后滤出沉淀,洗净、干燥、灼烧后,测得其质量为1.6 g。

根据上述实验回答下列问题。
(3)步骤②中,选择的装置是A接_________接___________(填代号),A装置中未使用分液漏斗的理由是____________________。
(4)根据上述实验数据计算,摩尔盐中n(NH4+):n(Fe2+):n(SO42-):n(H2O)=_____________
亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按如图装置进行制取。

已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)装置C的作用是 ;
(2)已知装置B中的产物有ClO2气体,则装置B中反应的化学方程式为 ;装置D中反应生成NaClO2的化学方程式为 ;反应后的溶液中阴离子除了ClO2-、ClO3-、Cl-、ClO-、OH-外还可能含有的一种阴离子是 ;检验该离子的方法是 ;
(3)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;② ;③ ;④ 得到成品。
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是 ;
实验Ⅱ:样品杂质分析与纯度测定
(5)测定样品中NaClO2的纯度。测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+4I-+4H+=2H2O+2I2+Cl-,将所得混合液稀释成100 mL待测溶液。取25.00 mL待测溶液,加入淀粉溶液做指示剂,用c mol•L-1 Na2S2O3标准液滴定至终点,测得消耗标准液体积的平均值为V mL(已知:I2+2S2O32-=2I-+S4O62-)。请计算所称取的样品中NaClO2的物质的量为 。
锗及其化合物被广泛应用于半导体、催化剂等领域。以铅锌矿含锗烟尘为原料可制备GeO2,其工艺流程图如下。

已知:GeO2是两性氧化物;GeCl4易水解,沸点86.6℃
(1)第①步滤渣主要成分有 (填化学式),实验室萃取操作用到的玻璃仪器有 。
(2)第②步萃取时,锗的萃取率与V水相/V有机相(水相和有机相的体积比)的关系如下图所示,

从生产成本角度考虑,较适宜的V水相/V有机相的值为 。
(3)第④步加入盐酸作用 (答两点即可)。
(4)第⑤步反应的化学方程式 。
(5)检验GeO2·nH2O是否洗涤干净的操作是 。
海水中含有丰富的镁资源。锂(Li)与镁元素性质相似。
(1)某同学设计了从模拟海水中制备MgO的实验方案:

| 模拟海水中的 离子浓度(mol/L) |
Na+ |
Mg2+[来 |
Ca2+ |
Cl― |
HCO3―[来源 |
| 0.439 |
0.050 |
0.011 |
0.560 |
0.001 |
注:溶液中某种离子的浓度小于1.0×10-5mol/L,可认为该离子不存在;实验过程中,假设溶液体积不变。已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;
Ksp[Ca(OH)2]=4.68×10-6;Ksp [Mg(OH)2]=5.61×10-12
请回答:沉淀物X为 (写化学式);滤液N中存在的金属阳离子为 ;
步骤②中若改为加入 4.2 gNaOH固体,沉淀物Y为 (写化学式)。
(2)物质的量为0.10 mol的锂在只含有N2和O2混合气体的容器中燃烧,反应后容器内固体物质的质量m克,m的取值范围是 ;
(3)锂电池是新一代高能电池,目前已研究成功多种锂电池。某离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为LiCoO2+C6 CoO2+LiC6,则放电时电池的正极反应为 ;
CoO2+LiC6,则放电时电池的正极反应为 ;
(4)为了回收废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量AI、Fe等)可通过下列实验方法回收钴、锂。

①在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中的化学反应方程式为 。
②调整PH=5-6的目的是 。
三草酸合铁(Ⅲ)酸钾晶体K3[Fe(C2O4)3]•3H2O可用于摄影和蓝色印刷.可用如下流程来制备.

根据题意完成下列各题:
(1)若用铁和稀硫酸制备FeSO4•7H2O, (填物质名称)往往要过量.
(2)要从溶液中得到绿矾,必须进行的实验操作是 (按前后顺序填).
a.过滤洗涤
b.蒸发浓缩
c.冷却结晶
d.灼烧
e.干燥
某课外化学兴趣小组为测定三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•3H2O)中铁元素含量,做了如下实验:
步骤一:称量5.000g三草酸合铁酸钾晶体,配制成250ml溶液.
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成
二氧化碳,同时,MnO4-.被还原成Mn2+.向反应后的溶液中加入一定量锌粉,加热至黄色刚好消失,过
滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍里酸性.
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02ml,滴定中MnO4-,
被还原成Mn2+.
重复步骤二、步骤三操作,滴定消耗0.010mol/LKMnO4溶液19.98ml;
(3)配制三草酸合铁酸钾溶液需要使用的玻璃仪器除烧杯、玻璃棒以外还有 ;主要操作步骤依次是:称量、 、转移、 、定容、摇匀.
(4)加入锌粉的目的是 .
(5)实验测得该晶体中铁的质量分数为 .在步骤二中,若加入的KMnO4的溶液的量不够,则测得的铁含量 .(选填“偏低”“偏高”“不变”)
(6)某同学将8.74g无水三草酸合铁酸钾(K3[Fe(C2O4)3])在一定条件下加热分解,所得固体的质量为5.42g,同时得到密度为1.647g/L(已折合成标准状况下)气体.研究固体产物得知,铁元素不可能以三价形式存在,而盐只有K2CO3.写出该分解反应的化学方程式 .
草酸镍晶体(NiC2O4•2H2O)可用于制镍催化剂,某小组用废镍催化剂(成分为Al2O3、Ni、Fe、SiO2、CaO等)制备草酸镍晶体的部分实验流程如下:

已知:①Ksp(CaF2)=1.46×10﹣10,Ksp(CaC2O4)=2.34×10﹣9。
②相关金属离子生成氢氧化物沉淀的pH如下表(开始沉淀的pH按金属离子浓度为0.1mol•L﹣1计算).
| 金属离子 |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1.1 |
3.2 |
| Fe2+ |
5.8 |
8.8 |
| Al3+ |
3.0 |
5.0 |
| Ni2+ |
6.7 |
9.5 |
(1)“粉碎”的目的是 。
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图。“酸浸”的适宜温度与时间分别为 (填字母).

a.30℃、30min b.90℃、150min
c.70℃、120min d.90℃、120min
(3)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象是 ,将“沉镍”工序得到的混合物过滤,所得固体用75%乙醇溶液洗涤、110℃下烘干,得草酸镍晶体.用75%乙醇溶液洗涤的目的是 。
(4)在除铁和铝工序中,应先加入H2O2氧化,再加氢氧化镍调节pH值的范围为 ,第2步中加入适量NH4F溶液的作用是 。
(5)将得到的草酸镍晶体在真空中加热至320℃分解可重新制得单质镍催化剂,写出该制备过程的化学方程式: 。
(6)已知废镍催化剂中镍的质量分数为5.9%,则100kg废镍催化剂最多可制得 kg草酸镍晶体。(Ni:59,C:12,H:1,O:16)
辉铜矿(主要成分为Cu2S)经火法冶炼,可制得Cu和H2SO4,流程如下图所示:

(1) Cu2S中Cu元素的化合价是 价。
(2)Ⅱ中,电解法精炼粗铜(含少量Ag、Fe),CuSO4溶液做电解质溶液:
①粗铜应与直流电源的 极(填“正”或“负”)相连。
②铜在阴极析出,而铁以离子形式留在电解质溶液里的原因是 。
③电解一段时间后,溶液中Cu2+浓度 (填“减小”、“增大”、“不变”)。
(3)Ⅲ中,烟气(主要含SO2、CO2)在较高温度经下图所示方法脱除SO2,并制得H2SO4。

① 在阴极放电的物质是___________。
② 在阳极生成SO3的电极反应式是____________。
(4)检测烟气中SO2脱除率的步骤如下:
i.将一定量的净化气(不含SO3)通入足量NaOH溶液后,再加入足量溴水。
ii.加入浓盐酸,加热溶液至无色无气泡,再加入足量BaCl2溶液。
iii.过滤、洗涤、干燥,称量沉淀质量。
①用离子方程式表示i中溴水的主要作用____________。
②若沉淀的质量越大,说明SO2的脱除率越____________(填“高”或“低”)。
(5)次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性。H3PO2是一元中强酸,写出其电离方程式 ·
③NaH2PO2为_ (填“正盐”或“酸式盐”)其溶液显 (填“弱酸性”、“中性”或“弱碱性”)。
乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
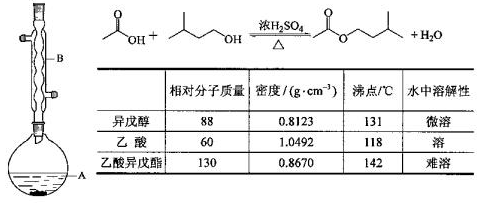
实验步骤:
在A中加入4.4g异戊醇,6.0g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别依次用少量水、饱和碳酸氢钠溶液且再用水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊脂3. 9 g。
回答下列问题:
(1)仪器B的名称是 ;
(2)在洗涤操作中,第一次水洗的主要目的是 ,第二次水洗的主要目的是 ;
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后(填标号〕 .
a、直接将乙酸异戊酯从分液漏斗的上口倒出
b、直接将乙酸异戊酯从分液端斗的下口放出
c、先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d、先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是 .
(5)实验中加入少量无水MgSO4的目的是 ·
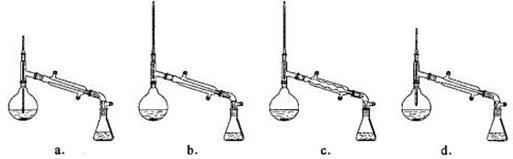
(6)在蒸馏操作中,仪器选择及安装都正确的是_ (填标号)。
(7)本实验的产率是_ (填标号).
a.30 % b.40 % c.60% d.90%
(8)在进行蒸馏操作时:若从130℃便开始收集馏分,会使实验的产率偏_ (填“高”或“低”),其原因是 。
(13分)半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)
已知:
①黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。
②PCl3遇水会强烈水解生成H3PO3和HCl;
③PCl3遇O2会生成POCl3,POCl3溶于PCl3。
④PCl3、POCl3的熔沸点如表:
| 物质 |
熔点/℃ |
沸点/℃ |
| PCl3 |
-112 |
75.5 |
| POCl3 |
2 |
105.3 |
请回答下列问题:
(1)A装置中制氯气的离子方程式为____________。
(2)B中所装试剂是_______;F中碱石灰的作用有两种,分别是______、_______。
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷。通干燥CO2的作用是_______。
(4)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后,通过_____(填实验操作名称),即可得到较纯净的PCl3。
(5)实验结束时,可以利用C中的试剂吸收多余的氯气,C中反应的离子方程式为_______。
(6)通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol/L的Na2S2O3,溶液滴定;
④重复②、③操作,平均消耗Na2S2O3溶液8.40mL。
已知:H3PO3+I2=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6,假设测定过程中没有其他反应,该产品中PCl3的质量分数为_________。
某科研小组探究工业废Cu粉(杂质含有SiO2、Al2O3、Fe2O3中的一种或几种)的组成并制备少量CuSO4·5H2O,实现废物综合利用,实验过程如下:
过程Ⅰ:

(1)废Cu粉中一定含有的杂质是 (填化学式)。
(2)写出过程②发生反应的离子方程式: 。
过程Ⅱ:

(3)综合过程Ⅰ、II,计算废Cu粉中各成分的质量之比是 (化为最简整数比)
过程Ⅲ:已知25℃时:
| 电解质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| 溶度积(Ksp) |
2.2×10-20 |
8.0×10-16 |
4.0×10-38 |
| 开始沉淀时的pH |
5.4 |
6.5 |
3.5 |
| 完全沉淀时的pH |
6.4 |
9.6 |
4.0 |
(4)在Ⅱ中所得蓝色溶液中加入一定量的H2O2溶液,调节溶液的pH范围为 ,然后过滤、结晶,可得CuSO4·5H2O。
(5)下列与 Ⅲ方案 相关的叙述中,正确的是 (填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+ 氧化为Fe3+ 的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH选择的试剂可以是氢氧化铜或氧化铜
D.在pH>4的溶液中Fe3+一定不能大量存在
I.高锰酸钾在实验室和工农业生产中有广泛的用途,实验室以二氧化锰为主要原料制
备高锰酸钾,其部分流程如下:

(1)第①步加热熔融应在铁坩埚中进行,而不用瓷坩埚的原因是 (用化学程式表示)。
(2)第④步通人适量CO2,发生反应生成Mn04和Mn02和碳酸盐,则发生反应的离子方程式为___ _。
(3)第⑥步加热浓缩至液面有细小晶体析出时,停止加热,冷却结晶、过滤、洗涤、干燥,干燥过程中,温度不宜过高,其原因是 (用化学方程式表示)。
(4)H2O2和KMn04都是常用的强氧化剂,若向H2O2溶液中滴加酸性高锰酸钾溶液,则酸性高锰酸钾溶液会褪色,写出该反应的离子方程式:_____ 。
Ⅱ.某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究S02和Cl2的性质。

(5)若从左端分别通人SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);
(6)若装置B中装有5.0 mL l.0 mol/L的碘水,当通入足量Cl2完全反应后,共转移了5.0×10-2 mol电子,该反应的化学方程式为 。
(7)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4:3;当Cl2与含X的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式__ __。
Na2S2O3俗称大苏打(海波)是重要的化工原料。用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3。已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g。常温下,从溶液中析出的晶体是Na2S2O3·5H2O。
现实验室欲制取Na2S2O3·5H2O晶体(Na2S2O3·5H2O的分子量为248)步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水。
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中。
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤。

④滤液在经过 、 后析出Na2S2O3·5H2O晶体。
⑤进行减压过滤并干燥。
(1)仪器B的名称是________。其作用是_____________。加入的硫粉用乙醇润湿的目的是 。
(2)步骤④应采取的操作是 、 。
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是 。如果滤液中该杂质的含量不很低,其检测的方法是: 。
(4)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用 (填“酸式”或“碱式”)滴定管来滴定(2S2O32-+ I2= S4O62-+ 2I-),滴定结果如下:
| 滴定次数 |
滴定前读数(mL) |
滴定滴定后读数(mL) |
| 第一次 |
0.30 |
31.12 |
| 第二次 |
0.36 |
31.56 |
| 第三次 |
1.10 |
31.88 |
则所得产品的纯度为 ,你认为影响纯度的主要原因是(不考虑操作引起误差) 。
(10分)某研究性小组借助A-D的仪器装置完成有关实验。

【实验一】收集NO气体。
(1)用装置A收集NO气体,正确的操作是________(填序号)。
a.从①口进气,用排水法集气 b.从①口进气,用排气法集气
c.从②口进气,用排水法集气 d.从②口进气,用排气法集气
【实验二】为了探究镀锌薄铁板上的锌的质量分数ω(Zn)和镀层厚度,查询得知锌易溶于强碱:Zn+2NaOH=Na2ZnO2+H2↑。据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
方案甲:通过测量试样与碱反应生成的氢气体积来实现探究目标。
(2)选用B和________(填仪器标号)两个装置进行实验。
(3)测得充分反应后生成氢气的体积为VL(标准状况),ω(Zn)=________。
(4)计算镀层厚度,还需要检索的一个物理量是________。
(5)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将________(填“偏大”、“偏小”或“无影响”)。
方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g。
(6)ω(Zn)=____________。
方案丙:通过称量试样与碱反应前后仪器、试样和试剂总质量(其差值即为H2的质量)实现探究目标。实验同样使用仪器C。
(7)从实验误差角度分析,方案丙________方案乙(填“优于”、“劣于”或“等同于”)。