(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为__ (填序号)。
| A.9 | B.13 | C.11~13之间 | D.9~11之间 |
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,混合溶液中
c(Na+)_______c(CH3COO-) ( “>”、“=”或“<”)。
(3)常温下,0.10mol/LNH4Cl溶液中各离子浓度由大到小的顺序是_____________ _。
(4)将NaHCO3溶液跟Al2(SO4)3溶液混合,现象是 ,相关反应的离子方程式是 。
(1)常温下,0.1mol·L-1的醋酸和0.1mol·L-1的盐酸各100mL分别与足量的锌粒反应,产生的气体体积前者____________后者。(填“大于”“等于”“小于”)
(2)常温下0.1mol·L-1的醋酸和pH=1的醋酸各100mL分别与足量的锌粒反应,产生的气
体前者比后者 。
(3)在25℃条件下将pH=5的氯化铵溶液稀释100倍,稀释后溶液的pH为(填选项字母,
下同)
A、5 B、7 C、3 — 5之间 D、5 — 7之间
(4)25℃时,向0.1mol·L-1的醋酸溶液中加入少量醋酸钠晶体,当晶体溶解后测得溶液pH将 。
A、增大 B、减小 C、不变 D、无法确定
(5)室温下,向0.1mol·L-1的H2SO4中加入足量的锌粒,若想减慢制取H2的速率,但又不
影响H2的体积,可以向硫酸溶液中加入 试剂。
A、碳酸钠晶体 B、醋酸钠晶体 C、滴加少量的硫酸铜溶液 D、水
(14分)常温下,将某一元酸 和
和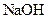 溶液等体积混合,混合前两种溶液的浓度和混合后所得溶液的
溶液等体积混合,混合前两种溶液的浓度和混合后所得溶液的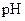 如下表(设混合后溶液体积变化忽略不计):
如下表(设混合后溶液体积变化忽略不计):
| 实验编号 |
 物质的量浓度 物质的量浓度( 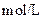 ) ) |
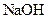 物质的量浓度 物质的量浓度( 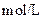 ) ) |
混合溶液的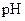 |
| 甲 |
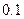 |
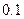 |
 |
| 乙 |
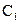 |
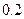 |
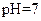 |
| 丙 |
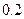 |
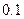 |
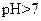 |
| 丁 |
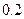 |
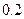 |
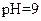 |
请回答;
(1)仅依据甲组数据分析, 的取值范围为 。
的取值范围为 。
(2)从乙组情况分析,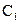 是否一定等于
是否一定等于 (选填“是”或“否”)。若
(选填“是”或“否”)。若 为弱酸,计算出该混合溶液达平衡时
为弱酸,计算出该混合溶液达平衡时 电离常数
电离常数 的近似值是 (用含
的近似值是 (用含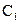 代数式表示)。
代数式表示)。
(3)丙组混合溶液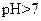 的原因是 ,该组混合溶液中离子浓度的大小关系是 。
的原因是 ,该组混合溶液中离子浓度的大小关系是 。
(4)若把某离子水解的物质的量占某离子总物质的量的百分数叫做“水解度”,依据丁组数据,推知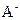 在该条件下的水解度是 ,该溶液中,水电离出的
在该条件下的水解度是 ,该溶液中,水电离出的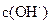 是
是 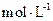 。
。
(7分) 由Cl-、Br-、CO32-、SO32-、SO42-、Na+、Fe3+中若干种离子组成的化合物溶于水后得无色溶液,然后依次进行实验,观察到的现象记录如下:
①向溶液中加足量新制饱和的氯水,溶液变黄,无气体产生,再加入汽油振荡,静置,汽油层呈橙红色,用分液漏斗分离。
②向分液后所得的水溶液中加入BaCl2和盐酸的混合溶液,有白色沉淀产生,过滤。
③在滤液中加入AgNO3和HNO3的混合液,有白色沉淀产生。
请认真分析后回答下列问题:
(1)原溶液中是否含有Na+ (填“是”“否”或“无法确定”,下同。),原溶液中是否含有Cl- 。
(2)步骤①中溶液变黄的原因是(用离子方程式表示):
______________________________________________________________________。
(3)原溶液中是否含有SO32-、SO42-: (填“都有”、“都没有”、“仅有一种”或“至少有一种”)。理由是_____________________________________________________。
下列溶液中微粒的物质的量浓度关系正确的是
A.向硝酸钙溶液里滴加稀盐酸得到pH=4的溶液中: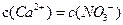 |
| B.将0.2 mol·L-1NaA溶液和0.1 mol·L-1盐酸等体积混合所得的碱性溶液中(A- 为酸根离子):c(Na+)>c(AlO2-)>c(C1-)>c(0H-) |
| C.0.1 mol/L-1NaAl02溶液中:c(Na+)>c(AlO2-)>c(OH-)>c(H+) |
| D.浓度均为0.1 mol·L-1的CH3COOH、CH3COONa的混合溶液中: |
2c(OH-)=2c(H+)+c(CH3COOH)
为减小和消除CO2对环境的影响,有科学家提出“绿色自由”构想。即先把空气吹人碳酸钾溶液,然后再把CO2从溶液中提取出来,并使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下: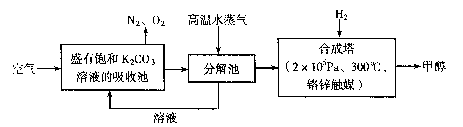
(1)写出分解池中反应的化学方程式 。
(2)在合成塔中,当有4.4kg CO2与足量H2完全反应,可放出热量4947 kJ,写出合成塔中反应的热化学方程式 。
(3)写出以氢氧化钾为电解质的甲醇燃料电池的负极反应式 。
当电子转移为 mol时,参加反应的氧气的体积是6.72L(标准状况下)。
(4)在体积为l L的密闭容器中,充人1mol CO2和3molH2在500°C下发生反应。有关物质的浓度随时问变化如下图所示。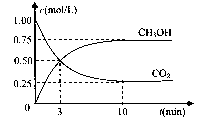
①从反应开始到平衡,H2的平均反应速率v(H2)= 。
②若其他条件不变,只将温度提高到800°C,再次达平衡时,n(CH3OH)/n(CO2)比值 (填“增大”、“减小”或“不变”)。
在常温下,用一定浓度的CH3COOH溶液滴定V mL同浓度NaOH溶液时得到的滴定曲线如下图: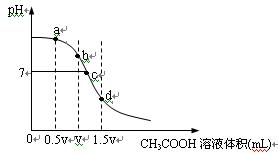
经测定某溶液中只含有Na+、CHCOO-、H+、OH- 四种离子,已知这种溶液含有一种或两种溶质。查资料表明等浓度的CH3COOH和CH3COONa的混合液显酸性。试完成下列各题:
(1)试分析上图所表示滴定过程的b、d两点可能的溶质组合:
b点_____________________,d点____________________。
(2)分别指出上图a、c两点所存在的微粒的离子浓度大小关系:
a点:_________________________________________________________________________
c点:_________________________________________________________________________
(3)水的电离程度与溶液中所溶解的电解质有关,试分析上图a、b、c、d点,水的电离程度最大的是______。
(4)有关这种溶液,下列的说法不正确的是_________
| A.若溶液中粒子间满足:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),则溶液中溶质可能为CH3COONa和NaOH |
| B.若溶液中粒子间满足c(CH3COO-)>c(Na+)>c(H+)>c (OH-),则溶液中溶质一定只有CH3COONa |
| C.若溶液中c(Na+)=c(CH3COO-),则该溶液一定显中性 |
| D.若溶液中c(CH3COOH)>c(Na+),则溶液一定显酸性 |
E.溶液中离子间可能满足c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
(5)若溶液是由体积相等的CH3COOH溶液和NaOH溶液混合而成,且恰好呈中性,则混合前c(CH3COOH)____________c(NaOH)(填“>”“<”或“=”)。
(1)某温度(t℃)时,水的Kw=10-13mol2·L-2,则该温度(填大于、小于或等于) 25℃,其理由是 。
(2)将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4的溶液bL混合,则:
①若所得混合液为中性,则a∶b= ;
②若所得混合液的pH=2,则a∶b= ;
饮用水安全状况与人类健康有着密切关系。重金属离子对河流、海洋会造成严重污染。沉淀法是处理含重金属离子污水常用的方法。
某工厂废水(pH=2.0,ρ=1.0 g·mL-1)中含Ag+、Pb2+等重金属离子,其浓度各约为0.01mol·L-1。排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 |
AgCl |
AgI |
AgOH |
Ag2S |
PbI2 |
Pb(OH)2 |
PbS |
| Ksp |
1.8×10-10 |
8.3×10-17 |
5.6×10-18 |
6.3×10-50 |
7.1×10-9 |
1.2×10-15 |
3.4×10-28 |
(1)你认为往废水中投 (填字母序号),沉淀效果最好。
| A.NaOH | B.Na2S | C.KI | D.Ca(OH)2 |
 (2)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)= 。
(2)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)= 。 (3)如果用食盐处理其只含银离子的废水,测得处理后的废水中NaCl的质量分数为0.117%,若环境要求排放标准为c(Ag+)低于1.0×10-18mol·L-1,则该工厂处理后的废水是否符合排放标准 。
(3)如果用食盐处理其只含银离子的废水,测得处理后的废水中NaCl的质量分数为0.117%,若环境要求排放标准为c(Ag+)低于1.0×10-18mol·L-1,则该工厂处理后的废水是否符合排放标准 。 (填“是”或 “否”)写出计算过程。
(填“是”或 “否”)写出计算过程。
NaHSO4是一种酸式盐。
(1)NaHSO4晶体熔化时的电离方程式为 。
(2)0.1mol·L-1的NaHSO4溶液的pH= 。
(3)NaHSO4溶液与NaHCO3溶液反应的离子方程式为 。
(4)2mol·L-1NaHSO4与1mol·L-1Ba(OH)2溶液等体积混合,反应的离子方程式为______________。若在反应的溶液中继续滴加Ba(OH)2溶液,反应的离子方程式为 。
水的电离平衡曲线如图所示: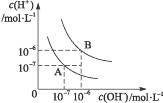
(1)若以A点表示25 ℃时水的电离平衡时的离子浓度,当温度升高到100 ℃时,水的电离平衡状态到B点,则此时水的离子积从____________________增加到_____________________。
(2)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100 ℃的恒温,致使混合液的pH=7,则Ba(OH)2与盐酸的体积之比为________________________________。
(3)已知AnBm的离子积=[C(Am+)]n·[C(Bn-)]m,式中的C(Am+)、C(Bn-)表示离子的物质的量浓度。若某温度下CA(OH)2溶解度为0.74 g,其饱和溶液密度设为1 g·mL-1,其离子积约为_____________________________________________。
配平下列化学方程式:
(1)K2Cr2O7+HCl(浓)——KCl+CrCl3+Cl2↑+H2O
(2)Fe3C+HNO3(浓)——Fe(NO3)3+CO2↑+NO2↑+H2O
(3)Fe(OH)3+NaOH+Cl2——Na2FeO4+NaCl+H2O
(4)S+Ca(OH)2——CaSx+CaS2O3+H2O
(5)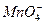 +H2S+H+——Mn2++S↓+H2O
+H2S+H+——Mn2++S↓+H2O
已知某温度下,KW=1×10-13。A为酸溶液,其pH=a;B为碱溶液,其pH=b。
(1)若A为强酸,B为强碱,且a+b=13,两者等体积混合后,溶液的pH=________;若此时溶液中碱的阳离子浓度大于酸根阴离子浓度,其原因可能是(用文字表述)_____________________。
(2)若A为强酸,B为强碱,二者按体积比为1:10混合后溶液显中性,则a+b=____。
(3)若A的化学式为HR,B的化学式为MOH,且a+b=13,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为_________________________________。
(4)在(3)的混合溶液中,微粒浓度大小关系一定正确的是___________(填序号)。
①c(MOH)>c(M+)>C(R-)>c(H+)>c(OH-)
②c(HR)>c(M+)>c(R-)>c(OH-)>c(H+)
③c(R-)>c(M+)>c(H+)>c(OH-)
④c(M+)>c(R-)>c(OH-)>c(H+)
⑤c(M+)+ c(H+)=c(R-)+c(OH-)
⑥c(MOH)=c(H+)-c(OH-)
同浓度的下列溶液中NH4+的浓度的由大到小顺序为
①NH4HSO4 ②(NH4)2SO4 ③(NH4)2Fe(SO4) ④NH4HCO3 ⑤(NH4)2CO3