水热法制备Fe3O4纳米颗粒的反应为:
3Fe2++2S2O32-+O2+xOH-===Fe3O4+S4O62-+2H2O,下列说法中错误的是
| A.每生成1 mol Fe3O4,反应转移的电子总数为4 mol |
| B.Fe2+和S2O32-都是还原剂 |
C.1 mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为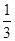 mol mol |
| D.x=4 |
足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与3.36 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
| A.60 mL | B.90 mL | C.120 mL | D.45 mL |
实验室将NaClO3和Na2SO3按物质的量为2:1放入烧杯中,同时滴入适量H2SO4,并用水浴加热,产生棕黄色的气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X的化学式为( )
| A.Cl2 | B.Cl2O | C.ClO2 | D.Cl2O3 |
有下列六种转化途径,某些反应条件和产物已省略,下列有关说法正确的是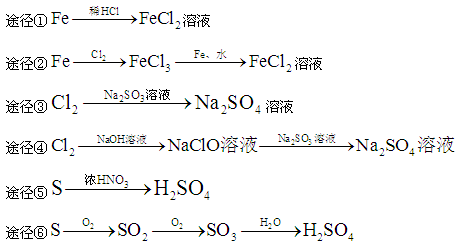
| A.由途径①和②分别制取1molFeCl2,理论上各消耗1molFe,各转移2mole- |
| B.由途径③和④分别制取1 mol Na2SO4,理论上各消耗1 mol Cl2,各转移2mol e- |
| C.由途径⑤和⑥分别制取1 mol H2SO4,理论上各消耗1mol S,各转移6mol e- |
| D.以上说法都不正确 |
实验室将NaClO3和Na2SO3按物质的量之比2∶1倒入烧瓶中,用水浴加热,同时滴入H2SO4,产生棕黄色气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X为
| A.Cl2 | B.Cl2O | C.Cl2O3 | D.ClO2 |
实验室将NaClO3和Na2SO3按物质的量之比2∶1 倒入烧瓶中,用水浴加热,同时滴入H2SO4,产生棕黄色气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X 为
| A.Cl2 | B.ClO2 | C.Cl2O | D.Cl2O3 |
在硫酸铁电化浸出黄铜矿精矿工艺中,有一主要反应:CuFeS2+4Fe3+═Cu2++5Fe2++2S,反应结束后,经处理获得单质硫x mol.下列说法正确的是( )
| A.反应中硫元素被氧化,所有铁元素均被还原 |
| B.氧化剂是Fe3+,氧化产物是Cu2+ |
| C.反应中转移电子的物质的量为xmol |
| D.反应结束后,测得溶液中三种金属离子的总物质的量为ymol,则原Fe3+的总物质的量为(y-x)mol |
工业废气中氮氧化物是主要污染物,为了治理污染,常通入NH3,发生反应NOx+NH3―→N2+H2O来治理污染.现有NO、NO2的混合气体3 L,用同温同压下3.5 LNH3使其恰好完全转化为N2,则混合气体中NO、NO2的物质的量之比为
| A.1∶1 | B.1∶3 | C.2∶1 | D.1∶4 |
一定量的KMnO4与足量的250mL浓盐酸反应,方程式为2KMnO4+16HCl(浓)=2KCl+5Cl2↑+2MnCl2+8H2O,反应结束后,共转移电子为5mol,则还原产物中,阳离子的物质的量浓度为(溶液的体积变化忽略不计)( )
| A.1mol/L | B.2mol/L | C.4mol/L | D.8mol/L |
研究性学习小组进行了一系列化学实验后,发现高锰酸钾分解后的含锰元素的化合物都能和浓盐酸反应制得氯气,且锰化合物的还原产物都是MnCl2.他们将6.32gKMnO4粉末加热一段时间,也不知道高锰酸钾是否完全分解,收集到0.112L气体后便停止加热了,冷却后放入足量的浓盐酸再加热,又收集到气体体积是(上述气体体积都折合成标准状况)
| A.0.448L | B.2.240L | C.2.016L | D.无法确定 |
将0.15molFe3O4完全溶解在足量稀硫酸中,然后加入K2Cr2O7溶液250mL,恰好使溶液中Fe2+全部氧化成Fe3+,Cr2O72-全部转化成Cr3+,则K2Cr2O7溶液的物质的量浓度是
| A.0.05mol/L | B.0.1mol/L | C.0.2mol/L | D.0.3mol/L |
0.3molSO32-恰好将0.2molXO4-离子还原,则X元素在还原产物中的化合价是( )
| A.+1 | B.+2 | C.+3 | D.+4 |
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中逐滴加入5mol/L NaOH溶液,所加的NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列说法不正确的是( )

| A.稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵 |
| B.图中C点对应溶液体积为48mL |
| C.原硝酸溶液中含硝酸的物质的量为0.5mol |
| D.样品中铝粉和铁粉的物质的量之比5:3 |
在100 mL含等物质的量的HBr和H2SO3的溶液中通入0.025 mol Cl2,有一半Br-变为Br2(已知Br2能氧化H2SO3)。则原溶液中HBr和H2SO3的浓度都等于
| A.0.16 mol·L-1 | B.0.02 mol·L-1 | C.0.20 mol·L-1 | D.0.25 mol·L-1 |
已知酸性高锰酸钾溶液可以将FeSO4氧化,反应的化学方程式为 2KMnO4+10FeSO4+8H2SO4===K2SO4+X+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示,则下列有关说法不正确的是
| A.方程式中的X为2MnSO4 |
| B.氧化性:KMnO4>Fe3+>I2 |
| C.根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.30 mol |
| D.AB段是高锰酸钾和碘化钾溶液反应,BC段的反应为2Fe3++2I-===2Fe2++I2 |