a mol FeS与b mol FeO投入到VLc mol/L稀硝酸中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
①(a+b)×63g ②(a+b)×189g ③(a+b)mol ④(cV-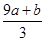 )mol
)mol
| A.①④ | B.②④ | C.②③ | D.①③ |
镁粉和铝粉分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如下图。下列说法正确的是
| A.镁粉和铝粉的物质的量之比为3∶2 |
| B.镁粉和铝粉质量之比为3∶2 |
| C.镁粉和铝粉的摩尔质量之比为2∶3 |
| D.镁粉和铝粉反应完所需时间之比为3∶2 |
依据离子反应:1N2H5++4Fe3+===4Fe2++aY+……(a是配平后Y的系数),在水溶液中N2H5+将Fe3+还原为Fe2+,则N2H5+被氧化后的产物Y可能是 ( )
| A.N2 | B.H2 | C.NH3 | D.NO |
24mL浓度为0.05mol・L﹣1的Na2SO3溶液,恰好与20mL浓度为0.02mol・L﹣1的K2Cr2O7溶液完全反应,已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为
| A.+2 | B.+3 | C.+4 | D.+5 |
两种硫酸盐按一定比例混合后共熔,可制得化合物X,X溶于水能电离出K+、Cr3+、SO42-,若将2.83 g X中的Cr3+全部氧化为Cr2O72-后,溶液中的Cr2O72-可和过量KI溶液反应,得到3.81g I2,反应的离子方程式为:Cr2O72-+I-+H+→Cr3++I2+H2O(未配平) 。若向溶有2.83 g X的溶液中,加入过量的BaCl2溶液,可得到4.66 g白色沉淀.由此可推断出X的化学式为 ( )
A.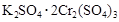 |
B.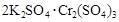 |
C. |
D.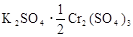 |
有反应方程式:Cu + 2H2SO4(浓) ∆ CuSO4 + SO2 ↑+ H2O,当32gCu完全反应时,被还原的H2SO4的物质的量为(已知:MCu=" 64" g/mol)
| A.0.5mol | B.1.0mol | C.1.5mol | D.2.0mol |
已知M2O2-n离子可与R2-离子作用,R2-被氧化为R单质,在M2O2-n的还原产物中,M为+3价;又如c(M2O2-n-)=0.3mol·L-1的溶液100mL可与c(R2-)="0." 6mol·L-1的溶液150mL恰好完全反应,则n值为
| A.4 | B.5 | C.6 | D.7 |
24mL浓度为0.05mol/L 的Na2SO3溶液恰好与20mL浓度为0.02 mol/L的K2Cr2O7溶液完全反应;已知Na2SO3被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为
| A.+2 | B.+3 | C.+4 | D.+5 |
研究性学习小组进行了一系列化学实验后,发现高锰酸钾分解后的含锰元素的化合物都能和浓盐酸反应制得氯气,且锰化合物的还原产物都是MnCl2.他们将6.32gKMnO4粉末加热一段时间,也不知道高锰酸钾是否完全分解,收集到0.112L气体后便停止加热了,冷却后放入足量的浓盐酸再加热,又收集到气体体积是(上述气体体积都折合成标准状况)
| A.0.448L | B.2.240L | C.2.016L | D.无法确定 |
将0.15molFe3O4完全溶解在足量稀硫酸中,然后加入K2Cr2O7溶液250mL,恰好使溶液中Fe2+全部氧化成Fe3+,Cr2O72-全部转化成Cr3+,则K2Cr2O7溶液的物质的量浓度是
| A.0.05mol/L | B.0.1mol/L | C.0.2mol/L | D.0.3mol/L |
0.3molSO32-恰好将0.2molXO4-离子还原,则X元素在还原产物中的化合价是( )
| A.+1 | B.+2 | C.+3 | D.+4 |
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中逐滴加入5mol/L NaOH溶液,所加的NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列说法不正确的是( )

| A.稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵 |
| B.图中C点对应溶液体积为48mL |
| C.原硝酸溶液中含硝酸的物质的量为0.5mol |
| D.样品中铝粉和铁粉的物质的量之比5:3 |
在100 mL含等物质的量的HBr和H2SO3的溶液中通入0.025 mol Cl2,有一半Br-变为Br2(已知Br2能氧化H2SO3)。则原溶液中HBr和H2SO3的浓度都等于
| A.0.16 mol·L-1 | B.0.02 mol·L-1 | C.0.20 mol·L-1 | D.0.25 mol·L-1 |
已知酸性高锰酸钾溶液可以将FeSO4氧化,反应的化学方程式为 2KMnO4+10FeSO4+8H2SO4===K2SO4+X+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示,则下列有关说法不正确的是
| A.方程式中的X为2MnSO4 |
| B.氧化性:KMnO4>Fe3+>I2 |
| C.根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.30 mol |
| D.AB段是高锰酸钾和碘化钾溶液反应,BC段的反应为2Fe3++2I-===2Fe2++I2 |