铁的单质和化合物在实验和实际生产中都有重要作用。
Ⅰ.某同学将Cl2通入FeCl2和KSCN混合溶液中,现象为:
| 操作 |
现象 |
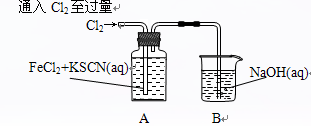 |
现象1:A中溶液变红 现象2:稍后,溶液由红色变为黄色 |
(1)B装置中反应的化学方程式____________ _ _______________ _______。
(2)A中溶液变红的原因是____________________ _ _________________________。
(3)为探究产生现象2的原因,该同学进行如下实验:
①取少量A中黄色溶液于试管加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在_ _。
②取少量A中黄色溶液于试管中,加入过量KSCN溶液,最终得到血红色溶液。
实验说明,Fe3+与SCN-生成红色Fe(SCN) 3的反应 可逆反应(是或不是)。
(4)该同学根据实验猜想,SCN-可能被氯水氧化。查资料得知SCN-的电子式为 ,
,
离子反应为:SCN-+8Cl2+9H2O=SO42-+NO3-+16Cl-+18H+ + CO2 ;
①上述反应中,0.5molSCN-被氧化时转移的电子总数为 个。
②若要检验产物中含有SO42-,常用的化学试剂是________(写试剂名称)。
Ⅱ.高铁电池因原料丰富、绿色环保而倍受关注。Zn-K2FeO4碱性电池的某电极的放电产物为FeOOH,该极电极为______极,电极反应式为________________ __。
已知适当条件下+7、+6、+4价锰的化合物都能和浓盐酸反应制得氯气且还原产物都是MnCl2.将6.32g KMnO4粉末加热一段时间后收集到0.112L气体(标准状况,后同),冷却后放入足量的浓盐酸再加热,又收集到VL黄绿色气体,下列说法正确的是
| A.V=2.24L |
| B.参加反应的HCl为0. 18mol |
| C.无法确定最终生成含钾化合物的数量是多少 |
| D.6.32g KMnO4粉末若直接与足量浓盐酸反应可得到2.24L Cl2(标准状况) |
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究方向。
(1)已知:CH4(g) + 2O2(g)=CO2(g) + 2H2O(g) ΔH1= a kJ•mol-1
CO(g) + H2O (g)=CO2(g) + H2 (g) ΔH2= b kJ•mol-1
2CO(g) + O2(g)=2CO2(g) ΔH3 = c kJ•mol-1
反应CO2(g) + CH4(g) 2CO(g) + 2H2(g) 的ΔH= kJ•mol-1。
2CO(g) + 2H2(g) 的ΔH= kJ•mol-1。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
① 在不同温度下催化剂的催化效率与乙酸的生成速率如图8所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是 。
② 为了提高该反应中CH4的转化率,可以采取的措施是 。
③ 将Cu2Al2O4溶解在稀硝酸中的离子方程式为 。
(3)以CO2为原料可以合成多种物质。
① 利用FeO吸收CO2的化学方程式为:6FeO + CO2=2Fe3O4 + C,则反应中每生成1molFe3O4,转移电子的物质的量为 mol。
② 以氢氧化钾水溶液作电解质进行电解,在铜电极上CO2可转化为CH4,另一电极石墨连接电源的 极,则该电解反应的化学方程式为 。
Cl2、HCl的混合气体通入足量的氢氧化钠溶液,充分反应后分析产物溶液中除大量OH− 外,还有Cl−、ClO−、ClO3−,并知这三种离子的物质的量比为9:2:1。试问原混合气体中Cl2与HCl体积比为
外,还有Cl−、ClO−、ClO3−,并知这三种离子的物质的量比为9:2:1。试问原混合气体中Cl2与HCl体积比为
| A.5:2 | B.3:1  |
C.2:5 | D.1:1 |
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问题
(1)生活中明矾常作净水剂,其净水的原理是 (用离子方程式表示)。
(2)常温下,取0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合,测得混合溶液后的pH=5。写出MOH的电离方程式: 。
(3)0.1mol/L的NaHA溶液中,测得溶液中的显碱性。则
①该溶液中c(H2A) c(A2-)(填“>”、“<”或“=”)。
②作出上述判断的依据是 (用文字解释)。
(4)含Cr2O 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理:
①绿矾为FeSO4·7H2O。反应(I)中Cr2O72-与FeSO4的物质的量之比为 。
②常温下若处理后的废水中c(Cr3+)=6.0×10-7 mol·L-1,则处理后的废水的pH=______。(Ksp[Cr(OH) 3]=6.0×10-31)
SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:
①SO2+2Fe3++2H2O=SO42-+2Fe2++4H+;
②Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
下列有关说法错误的是
| A.氧化性:Cr2O72->Fe3+>SO2 |
| B.K2Cr2O7能将Na2SO3氧化成Na2SO4 |
| C.每有1 mol K2Cr2O7参加反应,转移电子的数目为6NA |
| D.若有6.72 L SO2(标准状况)参加反应,则最终消耗0.2 mol K2Cr2O7 |
钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域。
(1)CoxNi(1-x)Fe2O4(其中Co、Ni均为+2)可用作H2O2分解的催化剂,具有较高的活性。
①该催化剂中铁元素的化合价为 。
②图1表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知: 法制取得到的催化剂活性更高;Co2+、Ni2+两种离子中催化效果更好的是 。
(2)草酸钴是制备钴的氧化物的重要原料。下图2为二水合草酸钴(CoC2O4·2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。
①通过计算确定C点剩余固体的化学成分为 (填化学式)。试写出B点对应的物质与O2在225℃~300℃发生反应的化学方程式: 。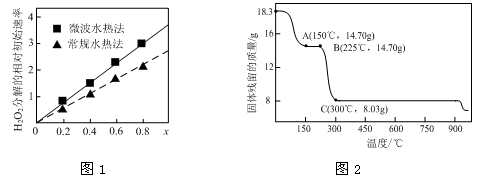
②取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL 5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比。
(15 分)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,根据要求解决下列问題:
(1)工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为 。
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
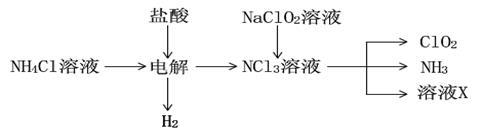
①电解时发生反应的化学方程式为 。
②溶液X中大量存在的阴离子有__________________。
③除去ClO2中的NH3可选用的试剂是 (填标号)。
a.水 b.碱石灰 c.浓硫酸 d.饱和食盐水
(3)为了测定混合气体中ClO2的含量,我们通常用酸化的KI溶液与之反应。
①请写出ClO2与碘化钾反应的离子方程式为 。
②如果反应过程中共消耗了 0.04 mol的KI,则此混合气体中ClO2的质量为________克。
研究性学习小组进行了一系列化学实验后,发现高锰酸钾分解后的含锰元素的化合物都能和浓盐酸反应制得氯气,且锰化合物的还原产物都是MnCl2.他们将6.32gKMnO4粉末加热一段时间,也不知道高锰酸钾是否完全分解,收集到0.112L气体后便停止加热了,冷却后放入足量的浓盐酸再加热,又收集到气体体积是(上述气体体积都折合成标准状况)
| A.0.448L | B.2.240L | C.2.016L | D.无法确定 |
将0.15molFe3O4完全溶解在足量稀硫酸中,然后加入K2Cr2O7溶液250mL,恰好使溶液中Fe2+全部氧化成Fe3+,Cr2O72-全部转化成Cr3+,则K2Cr2O7溶液的物质的量浓度是
| A.0.05mol/L | B.0.1mol/L | C.0.2mol/L | D.0.3mol/L |
Cl2是一种重要的化工原料,结合氯气的相关知识解决下列问题。
(1)运输氯气的钢瓶上应贴的标签为_____________。
| A.腐蚀品 | B.爆炸品 | C.有毒品 | D.易燃品 |
(2)工业上将氯气通入石灰乳制取漂白粉,写出该反应的化学方程式 。
(3)漂白粉的有效成分是(填化学式)_____________。
(4)实验室可以用KMnO4与浓盐酸在常温下制备Cl2。高锰酸钾溶液常用于物质的定性检验与定量分析。某化学兴趣小组在实验室里欲用KMnO4固体来配制500 mL 0.1mol/L的KMnO4溶液。
①需用的仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、 。
②下列操作会导致实验结果偏小的是 (填字母)。
a.转移时没有洗涤烧杯、玻璃棒
b.容量瓶内壁附有水珠而未干燥处理
c.颠倒摇匀后发现凹液面低于刻度线又加水补上
d.加水定容时俯视刻度线
③用配好的该浓度的KMnO4溶液与300mL 0.2mol/L的KI溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的体积为 mL。(已知MnO4-在此条件被还原为Mn2+)
(5)氯水中含有多种成分,因而具有很多性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量,已知:Cl2 + 2Br-=2Cl-+ Br2)。
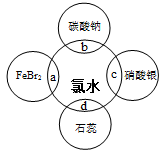
①能证明氯水具有漂白性的是__________(填“a”、“b”、“c”或“d”),现象是 。
②a中发生反应的离子方程式是 。
aL某浓度的SnC12溶液与过量FeC13溶液充分混合后,再加入 L 0.2000 mol·L-1 K2Cr2O7溶液,恰好完全反应,则SnC12的浓度为
L 0.2000 mol·L-1 K2Cr2O7溶液,恰好完全反应,则SnC12的浓度为
(提示:①2Fe3++Sn2+=2Fe2++ Sn4+;②6Fe2++Cr2O +14H+=6Fe3++2Cr3++7H2O)
+14H+=6Fe3++2Cr3++7H2O)
| A.0.3000 mol·L-1 | B.1.2000 mol·L-1 |
| C.0.0333 mol·L-1 | D.0.1333 mol·L-1 |
下图所示为含Cr化合物在一定条件下的转化: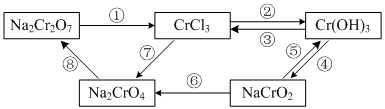
(1)①~⑧所示转化中,需要加入氧化剂才能实现的是_______(填写序号)。
(2)在上述转化中,既能与强酸反应又能与强碱反应的两性物质是______(填化学式)。
(3)转化①可通过下列反应实现:
①完成并配平的化学方程式:
__Na2Cr2O7+__KI+__H2SO4——__Cr2(SO4)3+__Na2SO4+__K2SO4+__I2+__H2O
②用单线桥表示电子转移的方向和数目
③反应中每转移0.4mol电子,生成I2的物质的量为______mol。