氧化还原反应有多种分类方法,其中根据参与电子转移的元素种类不同的分类方法最常见。下列反应中电子转移发生在相同价态的同种元素之间的有________(填反应编号,下同);电子转移发生在不同价态的同种元素之间的有________;电子转移发生在不同元素之间的有__________。下列反应中转移电子数为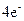 的有_____________。
的有_____________。
①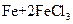 ===
===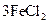
 ②
②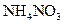

 ③
③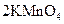
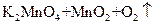
 ④
④
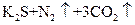
⑤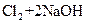 ===
===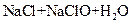
 ⑥
⑥
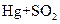
用15.8g KMnO4氧化75mL足量浓盐酸。反应方程式如下:
2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O
(1)有多少克HCl被氧化?
(2)若向反应后的剩余溶液中,加入足量AgNO3溶液,生成沉淀57.4g,求原浓盐酸的物质的量浓度?
在水中加入等物质的量的Ag+、Pb2+、Na+、SO42-、 NO3-、Cl-,该溶液放在用惰性材料做电极的电解槽中,通电片刻,则氧化产物和还原产物的质量之比
| A.35.5:108 | B.16:207 | C.8:1 | D.108:35.5 |
右图为实验室某浓盐酸试剂瓶的标签上的有关
数据,试回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为 mol/L。
若用KMnO4氧化上述 HCl。其反应方程式如下:
2KMnO4+16HCl(浓)=2KCl+2MnCl 2+5Cl 2↑+8H2O
(2)该反应中的氧化剂是 、氧化产物
是 。
(3)1mol KMnO4完全反应,被还原的HCl的物质的量为 mol。
(4)8mol HCl完全反应,产生的Cl 2在标准状况下的体积为 升。
在氧化还原反应:2H2S + SO2 =" 3S" + 2H2O中,被氧化与被还原的硫原子数比是( )
| A.1:1 | B.1:2 | C.3:2 | D.2:1 |
在8NH3+3Cl2=N2+6NH4Cl反应中,若有21.3g Cl2参加反应,则被氧化的NH3的质量为 ( )
| A.13.6g | B.10.2g | C.6.8g | D.3.4g |
在KClO3 + 6HCl(浓)="===" KCl + 3Cl2↑ + 3H2O 的反应中,氧化剂和还原
剂的物质的量之比是
| A.1:5 | B.1 :6 | C.5:1 | D.6:1 |
在3BrF3 +5H2O==HBrO3+Br2 +9HF+O2反应中,若有15mol H2O作还原剂,则被水还原的BrF3的物质的量为 ( )
| A.6 mol | B.12mol | C.4mol | D.10 mol |
硫酸铵在强热条件下分解,生成氨、二氧化硫、氮气和水。反应中生成的氧化产物和还原产物的物质的量之比是
| A.1:3 | B.2:3 | C.3:1 | D.4:3 |
下列反应中,氧化剂与还原剂的物质的量之比为2 :1的是 ( )
| A.Zn + 2HCl = ZnCl2 + H2↑ |
| B.Cu +2 H2SO4(浓) = CuSO4 + SO2↑+ 2H2O |
| C.3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O |
| D.2Na + Cl2 = 2NaCl |
向含有1mol的FeCl2溶液中通入0.2molCl2,再加入含0.1mol X2O72-的酸性溶液,使溶液中Fe2+全部恰好氧化,并使 X2O72-还原为Xn+,则n值为( )
| A.2 | B.3 | C.4 | D.5 |
下将Cl2通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-的物质的量浓度之比为11:1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为( )
| A.1:3 | B.4 :3 :3 |
C.2:1 | D.3:1 |
已知反应3S+6KOH(浓) 2K2S+K2SO3+3H2O,则反应中氧化剂和还原剂的质量比是 ( )
2K2S+K2SO3+3H2O,则反应中氧化剂和还原剂的质量比是 ( )
| A.3∶1 | B.1∶3 | C.2∶1 | D.1∶2 |
在 K2Cr2O7 + 14HCl ="===" 2KCl + 2CrCl3 + 3Cl2+ 7H2O反应中。
="===" 2KCl + 2CrCl3 + 3Cl2+ 7H2O反应中。
(1) 元素被氧化, 是氧化剂,氧化产物是 ;
(2)此反应若转移了12mol的电子,则生成氯气 L(标准状况)