吉林省长春市十一高中高三上学期期中考
随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品氧化变质,在包装袋中可以放入的化学物质是( ) 
| A.无水硫酸铜 | B.硫酸亚铁 | C.食盐 | D.生石灰 |
下列各组干燥气体和溶液,其中可以进行喷泉实验,且液体几乎充满烧瓶的是( )
| A.Cl2,饱和食盐水 | B.CO2,碳酸氢钠溶液 |
| C.SO2,稀氨水 | D.NO2,水 |
下列叙述正确的是( )
| A.常见金属铁和铝在工业上是由热还原法制得的 |
| B.二氧化硅晶体被广泛用于制作太阳能电池和光导纤维 |
| C.玛瑙和餐桌上的瓷盘都是硅酸盐制品 |
| D.钢材和硬币都是合金,若改变这些合金的原料配比会改变这些合金的性能 |
下列替代过程合理的是( )
| A.医院用BaCO3代替BaSO4作“钡餐” |
| B.家庭用食用醋代替CO2来增强漂白粉的漂白性 |
| C.工业上用电解AlCl3代替Al2O3来冶炼铝 |
| D.实验室用Ca(OH)2溶液代替CaCl2溶液来鉴别Na2CO3和NaHCO3 |
在下列各溶液中,离子一定能大量共存的是( )
| A.强碱性溶液中:K+、Al3+、Cl-、SO42- |
| B.含有0.1 mol·L-1 Fe3+的溶液中:K+、Mg2+、I-、NO3- |
| C.含有0.1 mol·L-1Ca2+溶液在中:Na+、K+、CO32-、Cl- |
| D.室温下,pH=1的溶液中: Na+、Fe3+、NO3-、SO42- |
下列有关化学与生活的说法不正确的是( )
| A.采用原煤脱硫技术,可减少燃煤产生的SO2 |
| B.硅酸钠的水溶液俗称水玻璃,可用作木材防腐剂 |
| C.自来水厂可用氯气来杀菌消毒,因此氯气无毒 |
| D.维生素C具有还原性,可用作食品抗氧化剂 |
等物质的量的镁和铝混合均匀后,分为等量的四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是( )

























| A.3 mol•L-1HCl溶液 | B.3 mol•L-1HNO3溶液 |
| C.8 mol•L-1NaOH溶液 | D.18 mol•L-1 浓H2SO4溶液 |
对下列氧化还原反应中转移电子数的判断,不正确的是( )
| A.H2S+H2SO4(浓)=S↓+SO2↓+2H2O:6e- |
B.3Cl2+6KOH 5KCl+KClO3+3H2O:5e- 5KCl+KClO3+3H2O:5e- |
| C.2Na2O2+2H2O=4NaOH+O2↑:2e- |
| D.2H2S+SO2=3S+2H2O:4e- |
下列有关物质检验的实验结论正确的是( )
| 选项 |
实 验 操 作 及 现 象 |
实 验 结 论 |
||
|
下列离子方程式正确的是( )
A.向明矾溶液中滴加过量氨水: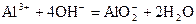 |
B.向烧碱溶液中通入少量二氧化碳: |
C.向纯碱溶液中加入少量醋酸: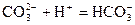 |
D.向小苏打溶液中加入少量石灰水: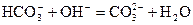 |
下列反应属于氮的固定的是( )
| A.空气在雷电作用下所产生NO | B.NO和O2生成NO2 |
| C.铜与浓硝酸反应产生NO2 | D.NH4Cl与Ca(OH)2反应生成NH3 |
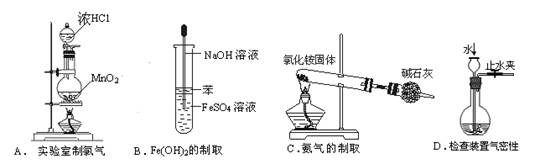
下图装置可用于收集气体X并验证其某些化学性质,你认为正确的是( )

| 选项 |
气体 |
试剂 |
现象 |
结论 |
|
锡青铜(铜锡合金)文物常有Cu2(OH)3Cl覆盖在其表面。下列说法正确的是( )
A.锡青铜的熔点比纯铜高 |
B.在自然环境中,锡青铜中的锡对铜起保护作用 |
C.锡青铜文物在潮湿环境中的腐蚀比干燥环境中慢 |
D.生成Cu2(OH)3Cl覆盖物是电化学腐蚀过程,但不是化学反应过程 |
下列说法正确的是( )
①氨可以用浓硫酸干燥也可用无水CaCl2干燥;
②SiC俗称金刚砂,可用作砂纸、砂轮的磨料;
③漂白粉和漂白精的有效成分都是Ca(ClO)2;
④NO在人体的血管系统内具有传送信号的功能,也是大气污染物之一;
⑤氧化铜可作为制造玻璃、搪瓷的红色颜料。
| A.①③⑤ | B.②③④ | C.①②⑤ | D.②③⑤ |
氯气是一种重要的工业原料。工业上利用反应在3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法正确的是( )
| A.若管道漏气遇氨就会产生白雾 | B.该反应利用了Cl2的强还原性 |
| C.该反应属于氧化还原反应 | D.生成1molN2有3mol电子转移 |
下列叙述正确的是( )
| A.阳离子只有氧化性,阴离子只有还原性 |
| B.含氧酸可作氧化剂而无氧酸不能 |
| C.工艺师利用盐酸刻蚀石英制作艺术品 |
| D.已知还原性:Fe2+>Br-可知反应2Fe3++2Br-=2Fe2++Br2不易进行 |
下列说法不正确的是( )
①将CO2通入溶有足量氨气的BaCl2溶液中,无白色沉淀生成
②将盐酸、KSCN溶液和Fe(NO3)2溶液三种溶液混合,混合溶液显红色
③向某溶液中滴入盐酸酸化的BaCl2溶液产生白色沉淀,证明溶液中一定含有SO42-
④将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,然后按入水中,两者放出的氢气质量相等
| A.只有② | B.①②③ | C.①③④ | D.①②③④ |
将适量铁粉放入FeCl3溶液中,完全反应后,溶液中的Fe2+和Fe3+浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是( )
| A.2︰3 | B.3︰2 | C.1︰2 | D.1︰1 |
草酸溶液能使酸性KMnO4溶液褪色,其离子方程式为
MnO4-+H2C2O4+H+→CO2↑+Mn2++ (未配平)。关于此反应的叙述正确的是( )
(未配平)。关于此反应的叙述正确的是( )
| A.该反应的氧化剂是H2C2O4 | B.1molMnO4-在反应中失去5mol电子 |
| C.该反应右框内的产物是OH- | D.配平该反应后,H+的计量数是6 |
物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是( )
| A.1:4 | B.1:5 | C.2:3 | D.2:5 |
将钠、镁、铝各0.3mol分别放入100ml 1mol/L的盐酸中,在同温同压下产生的气体体积比是( )
| A.1:2:3 | B.6:3:2 | C.3:1:1 | D.1:1:1 |
向含有1mol的FeCl2溶液中通入0.2molCl2,再加入含0.1mol X2O72-的酸性溶液,使溶液中Fe2+全部恰好氧化,并使 X2O72-还原为Xn+,则n值为( )
| A.2 | B.3 | C.4 | D.5 |
A~G各物质间的关系如下图,其中B、D为气态单质。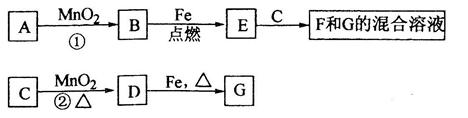
请回答下列问题:
(1)物质C和E的名称分别为_____________________、_______________________;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为_________________;
若只能在加热情况下进行,则反应物A的化学式(分子式)为_______________________;
(3)反应②的化学方程式为___________________________________________________;
(4)新配制的F溶液应加入______________以防止其转化为G。检验G溶液中阳离子的常用试剂是__________________,实验现象为_____________________________________。
为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置。试填空。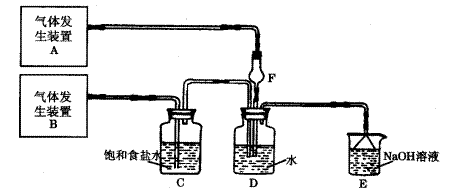
(1)D装置中主要反应的离子方程式为 ;F仪器的作用是: ;
(2)为验证通入D装置中气体是Cl2还是SO2过量,兴趣小组的同学准备了以下试液:
a. 氯化铁 b. 氯化亚铁 c. KMnO4(H+) d. 苯酚 e. 品红
若验证Cl2稍过量:取适量D中溶液滴加至盛有 (选填一个符号)试剂的试管内,再加入 _ (选填一个符号)试剂,发生的现象是: 。
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
NO3-+4H++3e-=NO+2H2O ; KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式: 。
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是 mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:
。
(5)KMnO4在酸性溶液中发生还原反应的反应式: ______ 。
已知:A、B为常见的非金属单质且均为气体;甲、乙为金属单质,乙在I的浓溶液中发生钝化;C、H、J的溶液均呈碱性.各物质间的转化关系如下(部分生成物未给出,且未注明反应条件):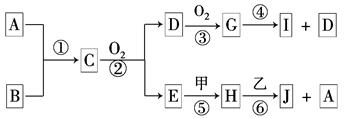
(1)写出反应②的化学方程式为_________________________________________。
(2)反应④中每消耗1 mol G,转移电子的物质的量为______________。
(3)反应⑥的离子方程式是___________________________________________。
(4)实验室中保存I的方法是____________________________。



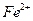

 粤公网安备 44130202000953号
粤公网安备 44130202000953号