乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1)CaC2中C2- 2与O2+ 2、N2互为等电子体,O2+ 2的电子式可表示为 ;1mol O2+ 2中含有的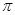 键为 mol。
键为 mol。
(2)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为 。
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是 、 。
(4)CaC2晶体的晶胞结构与NaCl晶体的相似(如右图所示),但CaC2晶体中有哑铃形的C2- 2存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离相等且最近的C2- 2数目为 。

氨和水都是常用的试剂。请回答下列问题:
(1)氮元素在元素周期表中的位置是 ;基态氮原子的核外电子中,未成对电子数与成对电子数之比为____________。
(2)NH3分子可结合一个H+形成铵根离子(NH)。
①NH3分子中N原子的杂化类型是____________。
②NH3分子与H+结合的过程中未发生改变的是____________(填选项字母)。
A.微粒的空间结构 B.N原子的杂化类型 C.H—N—H的键角
(3)将氨气通入CuSO4溶液中,产生蓝色沉淀,继续通过量氨气,沉淀溶解,得到蓝色透明溶液。[Cu(H2O)6]2+(水合铜离子)和[Cu(NH3)4]2+中共同含有的化学键类型是 。生成蓝色沉淀的离子方程式是 。
氮元素可以形成多种分子和离子,如NH3、N2H4、N2-、NH4+、N2H62+等。回答以下问题:
(1)N的基态原子中,有_________个运动状态不同的未成对电子;
(2)某元素原子与N3-含有相同的电子数,其基态原子的价电子排布图是____________;
(3)NH3、N2H4、NH4+、N2H62+四种微粒中,同种微粒间能形成氢键的有_________;不能作为配位体的有_______;
(4)纯叠氮酸HN3在常温下是一种液体,沸点较高,为308.8K,主要原因是_______;
(5)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物.
①N2H4分子中氮原子的杂化类型是_________;
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g)
若该反应中有4mol N-H键断裂,则形成的π键有_________mol;
(6)肼能与硫酸反应生成N2H6SO4.N2H6SO4化合物类型与硫酸铵相同,则N2H6SO4内微粒间作用力不存在_________(填标号)
a.离子键 b.共价键 c.配位键 d.范德华力
二氧化氯(ClO2)是国际公认高效、安全的杀菌、保鲜剂,是氯制剂的理想替代品。工业上制备ClO2的方法很多,NaClO3和NaClO2是制取ClO2的常见原料。
完成下列填空:
(1)以下反应是制备ClO2的一种方法:H2C2O4 + 2 NaClO3 + H2SO4 → Na2SO4 + 2 CO2↑ + 2 ClO2↑ + 2 H2O,上述反应物中属于第三周期的元素的原子半径大小顺序是__________;其中原子半径最大元素的原子,其核外有 种不同能量的电子。
(2)ClO2的分子构型为“V”形,则ClO2是______________(选填“极性”、“非极性”)分子,其在水中的溶解度比氯气__________(选填“大”、“小”、“一样”)。
(3)ClO2具有强氧化性,若ClO2和Cl2在消毒时自身均被还原为Cl-,ClO2的消毒能力是等质量Cl2的___________倍(保留2位小数)。
(4)若以NaClO2为原料制取ClO2,需要加入具有________(填“氧化”、“还原”)性的物质。
(5)工业上将氯碱工业和制取NaClO3联合进行。研究发现,电解时,不同反应环境下的总反应分别为:
4 NaCl + 18 H2O → 4 NaClO3 + 3 O2↑+ 18 H2↑(中性环境)
NaCl + 3 H2O → NaClO3 + 3 H2↑(微酸性环境)
①电解时,氢气在__________极产生。
②更有利于工业生产NaClO3的反应环境是___________,理由__________________。
铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域.一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)Cu+基态的电子排布式可表示为____________。
(2)1mol甲醛(HCHO)中含有的σ键数目为______________。
(3)氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如图),a位置上Cl原子的杂化轨道类型为______________。这两种不同化合物的化学式分别为________________、_______________。
(4)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应生成铜氨离子Cu(NH3)42+,①反应的离子方程式为_________;②[Cu(NH3)4]2+中存在的化学键类型有_______(填序号)。
| A.配位键 | B.离子键 | C.极性共价键 | D.非极性共价键 |
(5)金属铍与氯气也可以形成化合物,在气态二氯化铍中有单体BeCl2和二聚体(BeCl2)2;在晶体中变形成多聚体(BeCl2)n。试画出各种存在形式的结构式,并指出对应Be原子的杂化轨道类型。
结构式_________杂化轨道类型________
结构式_________杂化轨道类型________
结构式_________杂化轨道类型________
CaC2可用于固氮:CaC2+N2 CaCN2+C,CaCN2(氰氨化钙)和水反应可生成NH3。
CaCN2+C,CaCN2(氰氨化钙)和水反应可生成NH3。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式: 。
(2)C、N、O三种元素的第一电离能由小到大的顺序是 。
(3)NH3中N原子的杂化方式为 ;根据价层电子对互斥理论推测CO32-的空间构型为 。
(4)CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有 (填写一种化学式即可);写出CaCN2水解反应的化学方程式
据2014年1月17日网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构,是一种高能量分子。
(1)下列有关O4的说法正确的是:
| A.O4分子内存在极性共价键 |
| B.合成O4的反应可看作核聚变反应,即不属于化学变化 |
| C.O4与O3、O2都是氧的同素异形体 |
| D.O4不可用作氧化剂 |
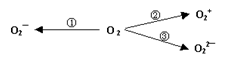
(2)制备含O2-、O22-甚至O2+的化合物都是可能的,通常它们是在氧分子进行下列各种反应时生成的:上述反应中, (填序号)相当于氧分子的氧化; (填序号)相当于氧分子的还原。
(3)写出O22—的电子式:
(4)O2[PtF6]是一种含有O2+的化合物,请写出一种含有O2-的氧化物的化学式:______________。
X、Y、Z、W、Q、R六种短周期主族元素,原子序数依次增大,Z基态原子核外有三个未成对电子,Y、Z、W分别与X形成常见化合物的分子结构依次为正四面体、三角锥形和V形,Q的各级电离能如下表,W与R是同族元素。
| Q |
I1 |
I2 |
I3 |
I4 |
I5 |
… |
| 电离能(kJ/mol) |
496 |
4562 |
6912 |
9543 |
13353 |
… |
回答下列有关问题:
(1)W原子的价电子排布图为______________________。
(2)化合物X 2W2的电子式_________,化合物XYZ的结构式__________。
(3)相同条件下,YW2、RW2两者在水中的溶解度较大的是 (写分子式),原因是 。
(4)RW3分子中的键角___________,RW32-分子的立体构型是_______________形。
(5)X、Z、W、三种元素所形成的常见离子化合物的化学式为 ,YW2中的化学键类型为 共价键(填“极性”或“非极性”),根据等电子原理,指出与YW互为等电子体且含有Z原子的微粒有 (要求写一种即可)。
今有aX、bY、cZ三种元素。已知:①各原子序数a、b、c均小于20,且a+b+c=25; ②元素Y的原子价电子构型为ns2npn+2; ③X和Y在不同条件下可形成X2Y和X2Y2两种化合物,Y和Z在不同条件下可形成ZY和ZY2两种化合物; ④Z的硫化物的相对分子质量与Z氯化物的相对分子质量之比为38︰77。回答下列问题:
(1)X: (写元素名称);Z的价电子排布图为: 。
(2)X2Y2的电子式 ,属于 化合物(填“离子”或“共价”)。
(3)Z的硫化物的VSEPR模型为 ,分子空间构型为 ;Z的氯化物的VSEPR模型和分子空间构型分别是 、 ,其中Z原子分别以 杂化轨道成键,根据原子轨道成键方式分,Z的硫化物分子中含有的键的种类及数目是 、 。
下表为长式周期表的一部分,其中的编号代表对应的元素。
| ① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
② |
|
|
|
|
|
|
|
|
|
|
|
③ |
|
|
|
|
| |
④ |
|
|
|
|
|
|
|
|
|
|
⑤ |
|
|
⑥ |
⑦ |
|
| |
⑧ |
|
|
|
|
|
⑨ |
|
|
⑩ |
|
|
|
|
|
|
|
请回答下列问题:
(1)按电子排布,可把周期表中的元素划分成5个区,请在上图中划出区域并注明。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为 ;③和⑦形成的一种常见溶剂的化学式为 ,其立体构型为__________,键角为______。
(3)某元素原子的价电子排布式为nsnnpn+1,该元素原子的最外电子层上孤电子对数为 ;该元素与元素①形成的最简单分子X属于 分子(填“极性”或“非极性”)。
(4)元素④的第一电离能 元素⑤(选填“>”、“=”、“<”)的第一电离能;元素⑥的电负性 元素⑦(选填“>”、“=”、“<”)的电负性。
(5)元素⑥和①形成的化合物的结构式为 ; 元素⑨的基态原子核外电子排布式是 。
(6)某些不同族元素的性质也有一定的相似性,如上表中元素②与元素⑤的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式
有如下有机物:
① ②
② ③
③
④CH3CH=CHCH3 ⑤ ⑥
⑥ ⑦
⑦
(1)互为同分异构体的是:__________,存在手性异构体的是:____________,存在顺反异构体的是__________,互为同系物的是(任写一对):__________;

(2)氢核磁共振(1H-NMR)图谱如上图所示的有_______________________;
(3)上述物质中,不属于同分异构体,相同质量时,在氧气中完全燃烧消耗的氧气的质量完全相同的烃是:____________________;
(4)有机物④的系统命名法名称是_____________________;
(5)有机物⑤的键线式_____________,其分子中碳原子_______杂化。
(1)I.短周期某主族元素M的电离能情况如图(A)所示,则M元素位于周期表的第____族;
Ⅱ.图B折线c可以表达出第____________族元素氢化物的沸点的变化规律。两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是:________________(填“a”或 “b”);
Ⅲ.部分有机物的熔沸点见下表:
根据物质结构理论,由这些数据你能得出的相关结论是(至少写2条):____________________;
(2)COCl2俗称光气,分子中C原子采取__________杂化成键;其中碳氧原子之间共价键含有___________(填字母):
a.2个σ键
b.2个π键
c.1个σ键.1个π键;
(3)金属是钛(22Ti) 将是继铜.铁.铝之后人类广泛使用的第四种金属,试回答:
I.Ti元素的基态原子的价电子层排布式为_________________________;
Ⅱ.已知Ti3+可形成配位数为6的配合物。现有紫色和绿色两种含钛晶体,其组成均为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种晶体的样品配成溶液;
b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量发现产生的沉淀质量关系为:绿色晶体为紫色晶体的 ,则绿色晶体配合物的化学式为_________________________。
,则绿色晶体配合物的化学式为_________________________。
(16分) Ⅰ请回答:
(1)CO2的电子式____________________
(2)钠燃烧不能用CO2灭火,用化学方程式表示其理由________________
(3)重晶石(BaSO4)不溶于酸,用饱和Na2CO3处理转化为易溶于酸的BaCO3,写出反应的离子方程式__________________
Ⅱ。化合物K3Fe(A2B4)3.3H2O 是重要的催化剂。将化合物K3Fe(A2B4)3.3H2O受热完全分解,只得到气体产物和固体产物。 经分析,气体产物只有甲、乙和水蒸气。已知甲、乙均由A、B两元素组成,且摩尔质量:M(甲)>M(乙)。A元素的最外层电子数是次外层电子数的2倍,B元素的主族序数是其所在周期数的3倍。 经分析,固体产物只有Fe、FeO和K2AB3。某同学再进行以下定量分析。

(1)甲的化学式:____________________
(2)溶液②与KMnO4发生氧化还原反应的离子方程式:_______________________
(3)由以上实验数据的分析可知n(Fe):n(FeO):n(K2AB3)= : :
(4)某同学认为:溶液②由紫红色变为无色,振荡试样半分钟内不变色,即可证明溶液②与KMnO4溶液反应达滴定终点。判断该同学设想的合理性并说明理由
I.请回答:
(1)CO2的电子式 。
(2)钠燃烧不能用CO2灭火,用化学方程式表示其理由 。
(3)重晶石(BaSO4)不溶于酸,用饱和Na2CO3处理转化为易溶于酸的BaCO3,写出反应的离子方程式 。
(4)完成以下氧化还原反应的离子方程式:
( )Cr2O + ( )H2O2+ _____ =( ) Cr3++ ( ) O2 ↑+ ________
+ ( )H2O2+ _____ =( ) Cr3++ ( ) O2 ↑+ ________
II.化合物K3Fe(A2B4)3·3H2O是重要的催化剂。将化合物K3Fe(A2B4)3·3H2O受热完全分解,只得到气体产物和固体产物。经分析,气体产物只有甲、乙和水蒸气。已知甲、乙均由A、B两元素组成,且摩尔质量:M(甲)<M(乙)。A元素的最外层电子数是次外层电子数2倍,B元素的主族序数是其所在周期数的3倍。经分析,固体产物只有Fe、FeO 和K2AB3。某同学再进行以下定量分析。

(1)甲的化学式: 。
(2)溶液②与KMnO4发生氧化还原的离子方程式: 。
(3)由以上实验数据的分析可知n(Fe):n(FeO) :n(K2AB3) = : : 。
(4)某同学认为:溶液②由紫红色变为无色,振荡试样半分钟内不变色,即可证明溶液②与KMnO4溶液反应到达滴定终点。判断该同学设想的合理性并说明理由 。
W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物之间可以反应生盐和水,该反应的离子方程式为__________________________
(2)W与Y可形成化合物W2Y,该化合物的电子式为_________。
(3)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是(用离子符号表示):_________>_________>_________>_________。
(4)Z的最高价氧化物与水反应得到一种稀溶液,写出该反应的离子方程式_________________________