研究物质的结构是研究物质性质的的基础,分析下列微粒的结构,完成问题:
(1) 根据VSEPR理论,BCl3的立体结构为:_______________,HCN的立体结构为:_________________。(文字表述,不必画图)两分子中中心原子的杂化类型分别为_________ ___________ 。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布式为 , 的未成对电子数是 。
的未成对电子数是 。
(3) 中的
中的 与
与 互为等电子体。已知
互为等电子体。已知 、
、 两种粒子中各原子最外层均为8电子稳定结构。
两种粒子中各原子最外层均为8电子稳定结构。 的电子式可表示为 ;
的电子式可表示为 ; 中含有的
中含有的 键数目为 。
键数目为 。
下列五种物质中① Ar ② H2O2 ③ NH4 NO3 ④ KOH ⑤ Na2O2 ⑥ CaCl2只存在共价键的是 ,只存在离子键的是 ,既存在共价键又存在离子键的是 ,不存在化学键的是 。(填写序号)
已知A、B、C、D是中学化学中常见的四种不同粒子,而且均是10电子的粒子,它们之间存在如图所示的转化关系: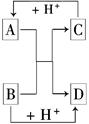
①A的电子式是
②加热条件下A与B在溶液中反应的离子方程式
③C中含有的化学键类型为:
④铝可以与B的某溶液反应,写出此反应的离子方程式
(12分)(1)用电子式表示H2O和MgBr2的形成过程
H2O MgBr2
(2)写出CO2、Na2O2、H2O2的电子式:
CO2 Na2O2 H2O2
(3) H2O以 键结合,MgBr2以 键结合。NaOH以 键结合,Na2O2以 键结合(填极性键、非极性键、离子键)
(4) 、
、 、
、 、D、E 5种粒子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:①
、D、E 5种粒子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:① ;②
;② 。
。 据此,回答下列问题:
据此,回答下列问题:
①写出①反应的离子方程式 。
② 和C-的电子式
和C-的电子式 ____________、C-____________。
____________、C-____________。
PtCl2(NH3)2可以形成两种固体,一种为淡黄色,在水中的溶解度小,另一种为黄绿色,在水中的溶解度较大,请回答下列问题:
⑴PtCl2(NH3)2是平面正方形结构,还是四面体结构
⑵请在以下空格内画出这两种固体分子的几何构型图,
淡黄色固体: ,黄绿色固体:
⑶淡黄色固体物质是由 分子组成,黄绿色固体物质是由 分子组成(填“极性分子”或“非极性分子”)
⑷黄绿色固体在水中溶解度比淡黄色固体大,原因是 。
(6分) 在H2、NH4Cl、SiC、CO2、HF中,由极性键形成的非极性分子有(1)________,由非极性键形成的非极性分子有(2)________,能形成分子晶体的物质是(3)________,含有氢键的晶体的化学式是(4)________,属于离子晶体的是(5)________,属于原子晶体的是(6)________。
(8分)
⑴在NaCl、NaOH、N2、H2S中,只含有离子键的是 ,只含有极性键的是 ,只含有非极性键的是 ,既含有离子键又有极性键的是 。
⑵写出短周期元素中有关的元素符号或名称。
①某元素最外层电子数是次外层电子数的2倍,该元素符号是 ;
②某元素次外层电子数是最外层电子数的2倍,该元素符号是 ;
③某元素K层与M层电子数相同,该元素名称是 ;
X、Y、Z三种常见的短周期元素可以形成XY2、Z2Y、XY3、Z2Y2、Z2X等化合物,已知Y的离子和Z的离子有相同的电子层结构,X离子比Y离子多一个电子层。试回答:
(1)写出X、Y、Z三种元素的符号和名称: ;
(2)分析Z2Y2中含有的化学键类型: ;
(3)写出Z2Y2与二氧化碳反应的方程式: ;
(4)用电子式表示X和Z两元素形成化合物的过程: 。
(7分)在HCl分子中,由H原子的一个 轨道与Cl原子的一个 轨道形成一个
键;在Cl2分子中两个Cl原子以 轨 道形成一个 键。在水分子中一个氧原子可以跟两个氢原子结合成水分子,并且两个O-H键间的夹角是104.5°,这个事实说明共价键具有 性和 性.
道形成一个 键。在水分子中一个氧原子可以跟两个氢原子结合成水分子,并且两个O-H键间的夹角是104.5°,这个事实说明共价键具有 性和 性.
⑴在下列物质中:①N2、②H2O、③H2、④H2O2、⑤C2H4、⑥HCl(用序号填空)其中只含有非极性键的是 ;只含有极性键的是 ;既含有非极性键又含有极性键的是 ;
(2)N≡N的键能为942kJ·mol-1,N—N单键的键能为247kJ·mol-1,计算说明N2中的 键更稳定(填“σ”或“π”)。
X、Y、Z、Q、E、F六种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在第二周期主族元素中电负性最大的元素。请回答下列问题:
(1)XZ2与YZ2分子的立体结构分别是 和 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 ;
(2)Q的元素符号是 ,它的核外电子排布式为 ,在形成化合物时它的最高化合价为 ;
(3)用氢键表示式写出E的氢化物溶液中存在的所有氢键 。
(4)F的氢化物是一种碱性气体,F还可与氢形成离子化合物FH5,其电子式为 ;其晶体的最小结构单元如图所示,经实验测得FH5晶体的密度为dg/cm3,阿伏加德罗常数用NA表示,则该晶体中阴离子与阳离子之间的最短距离为 cm。
水是自然界中普遍存在的一种物质,也是维持生命活动所必需的一种物质。
信息一:水的性质存在许多反常现象,如固态密度小于液态密度使冰浮在水面上,沸点相对较高使水在常温常压下呈液态等。
信息二:在20℃、1个大气压下,水可以结成冰,称为“热冰”(如下图):
试根据以上信息回答下列问题:
(1)s轨道与s轨道重叠形成的共价键可用符号表示为δs-s,p轨道以“头碰头”方式重叠形成的共价键可用符号表示为δp-p,则H2O分子中含有的共价键用符号表示为: 。
(2)位于第四周期,与氧元素同主族的元素名称是: ;其外围电子排布式是: 。
(3)下列物质熔化时,所克服的微粒间的作用与“热冰”熔化时所克服的作用类型完全相同的是: 。
| A.金刚石 | B.干冰 | C.食盐 | D.固态氨 |
(4)已知:2H2O  H3O++OH-,H3O+的立体构型是 ,H3O+中含有一种特殊的共价键叫做 。
H3O++OH-,H3O+的立体构型是 ,H3O+中含有一种特殊的共价键叫做 。
(5)根据等电子原理,写出短周期元素原子形成的与H3O+互为等电子体的分子或离子________。
(6)水的分解温度远高于其沸点的原因是:
________________________________________________________________________
甲.乙.丙.丁均具有如图所示的结构或结构单元。实线表示共价键,X.Y可同可不同。
已知:甲.乙晶体类型相同,单质甲能与乙发生置换反应,丙.丁.戊三种粒子均含有等量的总电子数,其中丙.戊是同一类晶体中的分子,戊在常温下呈液态,能产生两种10电子的离子,丁是阳离子且与丙符合“等电子原理”(具有相同电子数和原子数的分子或离子互称为等电子体)。
(1)写出液态戊产生两种等电子粒子的电离方程式: 。
(2)写出甲与乙发生置换反应的反应方程式: 。
(3)丙是目前重要的能源之一。
① 丙和戊在催化.加热条件下得到可燃性的两种气体,其反应的化学方程式是: 。
② 现代高能电池中,常用丙作燃料电池的原料,在碱性介质(KOH溶液)的情况下,其负极反应的电极方程式为 。
(4)含丁的硝酸盐溶液显酸性,原因是(用离子方程式表示):
化合物ICl电子式 ,其中I的化合价为 ,你判断I化合价依据是 ,预测ICl与H2O反应的化学方程式为 。你预测反应正确与否的实验依据是
(提示:AgI为黄色沉淀) (是/否)氧化还原反应。次碘酸的电子式 。
(2)写出3种由多个原子组成的含有与 电子数相同的微粒的化学式 、
电子数相同的微粒的化学式 、
、 。
下列表示分子结构的图示中,●表示短周期的几种元素的“原子实”[指原子除去最外电子层电子后剩余的部分,周围小黑点表示没有用于形成共价键的最外层电子,短线代表共价键。例如X2(X代表卤素原子):

回答下列问题:
(1)A、B、C、D四种“图示”中,所表示的物质可分为四组共_________种分子。这些物质的分子中的电子总数可能为________或________。
(2)分子的空间构型为正四面体的物质的分子式是________________。该组中,物质的稳定性顺序是________________;它们沸点的变化与其余各组相比________________(填“相同”或“不相同”),其原因是 ________________________________________ 。
(3)
写出上述物质中的两种间相互反应生成离子化合物的化学方程式:__________________ 。