前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2。
(1)六种元素中第一电离能最小的是_____________(填元素符号,下同)
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂)。请写出黄血盐的化学式___ _,1molAB一中含有π键的数目为__ ______ (阿伏加德罗常数的值为NA),黄血盐晶体中各种微粒间的作用力不涉及____ (填序号)。
a .金属键. b.共价键 c.配位键 d.离子键 e.氢键 f.分子间的作用力
(3)E2+的价层电子排布图为 ,很多不饱和有机物在E催化下可与H2发生加成反应:如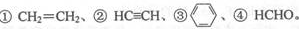 其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 ,它加成后产物甲醇的熔、沸点比CH4的熔、沸点高,其主要原因是 。
其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 ,它加成后产物甲醇的熔、沸点比CH4的熔、沸点高,其主要原因是 。
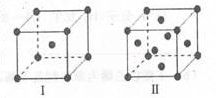
(4)金属C、F晶体的晶胞结构如图(请先判断对应的图),C、F两种晶体晶胞中金属原子的配位数之比为_ ___ 。金属C的晶胞中,若设该晶胞的密度为ag/cm3,阿伏加德罗常数的值为NA,C原子的摩尔质量为M g/mol,则表示C原子半径的计算式为 cm(不必化简)。
X、Y、Z、R为前四周期元素且原子序数依次增大。X的单质与氢气可以化合生成气体G,其水溶液pH>7;Y单质是一种黄色晶体;R基态原子3d轨道的电子数是4s轨道电子数的3倍。Y、Z分别与钠元素可以形成化合物Q和J,J的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L;Z与氢元素形成的化合物与G反应生成M。
请回答下列问题:
(1)M固体的晶体类型是 ,M中所含化学键有:
(2)YO2分子的立体构型名称为: ;
G分子中X原子的杂化轨道的类型是 。
(3)J的水溶液跟AgNO3溶液反应的化学方程式为: 。
(4)R的一种含氧酸根RO42-具有强氧化性,在其钠盐中加入稀硫酸,溶液变为黄色,并有无色气体产生,该反应的离子方程式是 。
X、Y、Z、W、Q五种元素原子序数依次增大,X为地壳中含量最高的元素,在周期表中Y与X、Z、Q相邻,Q与X最高能层上的电子数相同,W原子核外有七种不同能级的电子,且最高能级上没有未成对电子,W与X可形成W2X和WX两种化合物。
回答下列问题:
(1)X能与原子序数最小的元素形成原子个数比为1:1的分子,该分子的电子式为 。
(2)W2+的核外电子排布式为 。
(3)Z单质能溶于水,水液呈 色,在其中通人Y的某种氧化物,溶液颜色褪去,用化学方程式表示原因 。
(4)Y、Z元素的第一电离能Y Z(填“>”、“<”或“=”)。 X与地壳中含量第二的元素形成的化合物所属的晶体类型为 。
(5)已知X分别与元素碳、氮形成化合物有如下反应:
2CX(g)+X2(g)=2CX2(g) △H=—566.0kJ·mol-1
N2(g)+X2(g)="2NX(g)" △H=189.5kJ·mol-1
2NX(g)+X2(g)=2NX2(g) △H=—112.97kJ·mol-1
写出NX2与CX反应生成大气中存在的两种气态物质的热化学方程式: 。
(6)Y与磷原子形成P4Y3分子,该分子中没有π键,且各原子最外层均已达8电子结构,则一个P4Y3分子中含有的极性键和非极性键的个数分别为 个、 个。