Ⅰ.下面列出了几组物质或粒子,请将合适的组号填写在空格上。
①金刚石与“足球烯”(C60);
②D与T;
③16O、17O和18O;
④氧气(O2)与臭氧(O3);
⑤乙醇(CH3CH2OH)和甲醚(CH3OCH3);
(1)是同素异形体的 。
(2)是同位素的 。
(3)是同分异构体的 。
Ⅱ.在下列变化中:
①干冰气化
②硝酸钾熔化
③食盐溶于水
④HCl溶于水
⑤蔗糖溶于水
⑥HI分解
用序号填空:
(1)未破坏化学键的是 。
(2)仅离子键被破坏的是 。
(3)仅共价键被破坏的是 。
【化学——物质结构与性质】
A、B、C、D、E是原子序数依次增大的五种元素。B元素原子最外层电子数比内层多3个,C、D元素同主族且原子序数D为C的二倍,E元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,回答下列问题。
(1)E元素基态原子的外围电子排布图为_______。
(2)元素B、C、D的第一电离能由小到大排列顺序为_______(用元素符号表示)。
(3) DC3冷凝可形成一种D、C相间的六元环结构的三聚体,其中D原子的杂化方式
为_______。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和1:2,
两种化合物可任意比互溶,其主要原因是________。
(5)A、B、C、D、E五种元素组成某配位化合物X,其原子个数比为18:6:4:1:1,
该配位化合物X的化学式为_________。
(6) Sb的一种氧化物高于843K时会转化为长链的大分子,
其结构片段如图,则该分子中Sb和O的原子个数比为_______ 。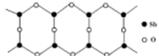
下列有关叙述正确的是
A. O和 O和 O中子数相同,质子数不同,互为同位素 O中子数相同,质子数不同,互为同位素 |
| B.H2O比H2S稳定,H-S键比H-O键更难断裂 |
| C.Na2O2晶体中阳离子与阴离子个数比为1:1 |
| D.Na2O晶体中存在离子键,是离子化合物 |
(18分)水是组成生命体的重要化学物质,有关水的反应有很多。
(1)水分子的空间构型为___________;水分子自身作用会生成阴、阳两种离子,其中阴离子的电子式是___________
(2)如图是某品牌饮用矿泉水标签的部分内容。请计算一瓶合格的这种矿泉水中硫酸根离子的物质的量不能超过___________。
(3)标况下将a L氨气溶于1L水中,得到的溶液密度为b g·cm﹣3。用化学方程式表示氨气溶于水显碱性的原因___________该溶液的物质的量浓度为___________mol·L﹣1。
(4)已知M是生活中常见的一种金属,将44.8 g M完全溶于很稀的过量硝酸,向所得溶液中加入足量固体烧碱并加热,放出6.72 L(标准状况)气体。M溶于该很稀的硝酸的离子方程式为___________________。M与水在高温条件下,生成1g气体吸热a kJ,写出该反应的热化学方程式_________________________________。
(5)味精是常用的调味品,当前味精生产主要采用淀粉发酵法,其中第一步是使淀粉水解为单糖。
①淀粉发生水解反应的化学方程式是_________________________________
②实验室中检验淀粉水解产物应选用的试剂可以是___________ (填字母)·
| A.NaOH溶液、氨水、AgNO3溶液 | B.H2SO4溶液、氨水、AgNO3溶液 |
| C.NaOH溶液、CuSO4溶液 | D.H2SO4溶液、CuSO4溶液 |
X、Y、Z、W、Q、R六种短周期主族元素,原子序数依次增大,Z基态原子核外有三个未成对电子,Y、Z、W分别与X形成常见化合物的分子结构依次为正四面体、三角锥形和V形,Q的各级电离能如下表,W与R是同族元素。
| Q |
I1 |
I2 |
I3 |
I4 |
I5 |
… |
| 电离能(kJ/mol) |
496 |
4562 |
6912 |
9543 |
13353 |
… |
回答下列有关问题:
(1)W原子的价电子排布图为______________________。
(2)化合物X 2W2的电子式_________,化合物XYZ的结构式__________。
(3)相同条件下,YW2、RW2两者在水中的溶解度较大的是 (写分子式),原因是 。
(4)RW3分子中的键角___________,RW32-分子的立体构型是_______________形。
(5)X、Z、W、三种元素所形成的常见离子化合物的化学式为 ,YW2中的化学键类型为 共价键(填“极性”或“非极性”),根据等电子原理,指出与YW互为等电子体且含有Z原子的微粒有 (要求写一种即可)。
A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为40,B、W同周期,D、E同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素的盐酸盐或硫酸盐可以用来净水,原理是_______________________(文字表述)。
(2)A2W2的分子中所含的化学键为________、________,经测定A2W2为二元弱酸,其酸性比碳酸的还要弱,请写出其第一步电离的电离方程式___________。
(3)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式____________________。
(4)元素D的单质在一定条件下,能与A单质化合生成一种氢化物DA,熔点为800℃,DA能与水反应放氢气,若将1 mol DA和1 mol E单质混合加入足量的水,充分反应后生成气体的体积是__________________(标准状况下)。
(5)D的某化合物呈淡黄色,可与氯化亚铁溶液反应。若淡黄色固体与氯化亚铁反应的物质的量之比为1∶2,且无气体生成,则该反应的离子方程式为____________________。
(6)在常温下用气体密度测定BW2的相对分子质量,实验值比理论值偏________(填 “高”或“低”),其原因是___________________。
分子晶体的熔点通常都在200℃以下,下列数据是对应物质的熔点:据此做出的下列判断中正确的是
| 物质 |
Na2O |
NaCl |
AIF3 |
AlCl3 |
BCl2 |
Al2O3 |
CO2 |
SiO2 |
| 熔点/℃ |
920 |
801 |
1291 |
190 |
-107 |
2073 |
-57 |
1723 |
A.NaCl晶体熔化时,吸收的热量用于破坏离子键
B.表中只有BCl3和干冰是分子晶体
C.碳和硅是同一主族,故CO2和 SiO2的晶体类型相同
D.两种含钠化合物是离子晶体,三种含铝化合物也是离子晶体
现有下列物质,用编号填空回答下列问题:
A.干冰
B.金刚石
C.氦
D.过氧化钠
E.二氧化硅
F.溴化铵
G.H2O2
H.氢氧化钠
(1)通过非极性键形成的原子晶体是: 。
(2)含有极性键的离子化合物是: 。
(3)含有离子键、共价键、配位键的化合物是: 。
(4)含有极性共价键的非极性分子是 。
(5)含有极性共价键和非极性共价键的极性分子是 。
(6)A、B、C、D四种物质的熔点从低到高的顺序为________________。
乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1)CaC2中C2- 2与O2+ 2、N2互为等电子体,O2+ 2的电子式可表示为 ;1mol O2+ 2中含有的 键为 mol。
键为 mol。
(2)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为 。
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是 、 。
(4)CaC2晶体的晶胞结构与NaCl晶体的相似(如右图所示),但CaC2晶体中有哑铃形的C2- 2存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离相等且最近的C2- 2数目为 。

A、B、C、D、E为原子序数依次增大的短周期元素,B、C相邻且同周期,C原子中含有8种运动状态不同的电子。A、C能形成两种化合物甲和乙,原子个数比分别为2∶1和1∶1,甲为常见的溶剂。D是地壳中含量最多的金属元素。E元素为同周期电负性最大的元素。D和E可形成化合物丙。F为第四周期未成对电子数最多的元素。请回答下列问题:
(1)写出F基态原子的外围电子排布式 。
(2)B和C比较,第一电离能较大的元素是 (填元素符号)。
(3)甲、乙两分子中含有非极性共价键的是 (填分子式)。
(4)已知化合物丙熔点190℃,沸点183℃,结构如右图所示。

①丙属于 晶体。
②丙含有的作用力有 (填序号)。
A 离子键 B 共价键 C 金属键
D 配位键 E 范德华力
(5)F3+与元素A、C、E构成配合物戊,在含有0. 1mol戊的溶液中加入过量AgNO3溶液,经过滤、洗涤、干燥后,得到28.7g白色沉淀。已知该配合物的配位数为6,则戊的化学式为 。
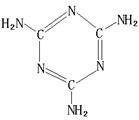
(6)三聚氰胺(结构如右图)由于其含氮量高被不法奶农添加到牛奶中来“提高”蛋白质的含量,造成全国许多婴幼儿因食用这种奶粉而患肾结石。三聚氰胺中N原子的杂化类型是 。
X、Y、Z、R、T、U分别代表原子序数依次增大的短周期主族元素。X元素原子的质子数等于其电子层数;Y的基态原子核外电子有5种不同的运动状态;Z与T同主族且原子序数T是Z的两倍;R元素的原子半径在短周期主族元素中最大。请回答下列问题:
(1)Z的基态原子电子排布式为_______;TZ32-离子的空间构型为_______。
(2)T、U的最高价氧化物对应的水化物酸性由强到弱的顺序为__________(填化学式)。
(3)化合物RU的晶体类型为 ;已知RU晶胞体积为Vcm3,RU的摩尔质量为M g/mol则该晶体密度p= (用含V、M的式子表示)。
(4)将Y2X6气体通人H20中反应生成一种酸和一种单质,该反应的化学方程式是 。(已知:Y的电负性为2.0,X的电负性为2.1)
以下微粒含配位键的是( )
①N2H5+ ②CH4 ③OH-④NH4+ ⑤Fe(CO)3 ⑥Fe(SCN)3 ⑦H3O+⑧[Ag(NH3)2]OH
| A.①④⑥⑦⑧ | B.③④⑤⑥⑦ | C.①④⑤⑥⑦⑧ | D.全部 |
下列说法中不正确的是
①水分子的电子式为 ②离子半径由小到大的顺序是:Mg2+<Na+<Cl-<S2-
②离子半径由小到大的顺序是:Mg2+<Na+<Cl-<S2-
③氮分子的电子式为 ④只含有离子键的化合物才是离子化合物
④只含有离子键的化合物才是离子化合物
| A.①② | B.③④ | C.①④ | D.②③ |
(Ⅰ)某钠盐溶液中通入足量氨气,无明显现象。再在所得溶液中通入过量CO2,产生大量白色沉淀。
(1)写出氨气的电子式 。
(2)该钠盐溶液中一定不可能含有下列哪种微粒 (填编号)。
| A.Cl- | B.Fe2+ | C.SiO32- | D.AlO2- |
(3)写出一个通入过量CO2时生成白色沉淀的离子方程式 。
(Ⅱ)电镀工业中往往产生大量的有毒废水,必须严格处理后才可以排放。某种高浓度有毒的含A离子(阴离子)废水在排放前的处理过程如下:
已知:9.0g沉淀D在氧气中灼烧后,产生8.0g黑色固体,生成的气体通过足量澄清石灰水时,产生10.0g白色沉淀,最后得到的混合气体除去氧气后,还剩余标况下密度为1.25g/L的气体1.12L。
(4)沉淀D的化学式是 。
(5)写出沉淀D在氧气中灼烧发生的化学方程式 。
(6)滤液C中还含有微量的A离子,通过反应②,可将其转化为对环境无害的物质,试用离子方程式表示该原理 。
(7)反应①为制得某种元素的低价X离子,试从氧化还原反应的角度分析,是否可以用Na2SO3溶液来代替B溶液 ,
并设计实验证明所用Na2SO3溶液是否变质 。
(18分)Ⅰ.(7分)次磷酸(H3PO2)是一种一元中强酸,具有较强的还原性。试回答下列问题:
(1)P的原子结构示意图为 ;
(2)NaH2PO2为 (“正盐”或“酸式盐”),溶液中有关离子浓度从大到小的顺序为 。
(3)H3PO2可将溶液中的银离子还原为银单质,若氧化剂与还原剂的物质的量之比为4︰1,则该反应的氧化产物的化学式为 。
Ⅱ.(11分)某无机化合物A的相对分子质量为184。在一定条件下,SCl2与氨完全反应生成A和淡黄色单质B及离子化合物X,且X的水溶液的pH<7。将18.4gA隔绝空气加强热可得到12.8g B和气体单质C。请回答下列问题:
(1)A的化学式为 ,C的电子式为 。
(2)写出SCl2与氨反应的化学方程式 。
(3)亚硝酸钠和X固体在加热条件下 (填“可能”或“不能”)发生反应,判断理由是 。
(4)请设计检验物质X的实验方案 。