将硼酸、发烟硫酸、萤石粉共热得到无色气体A,A为平面构型分子,密度约为空气的2.3倍,A用乙醚吸收后得到液态物质B。液态乙酸中存在微弱的自偶电离,离子电导率为139μS/cm,将B加入乙酸中形成均一透明的无色溶液,发现乙酸的离子电导率显著增强,达到1300-5800μS/cm,B与乙酸的混合溶液是具有良好应用前景的非水型电解质,与传统的水溶液电解质体系相比有独特的优势,扩大了电化学反应研究的物质范围和电位研究区间。试回答下列问题:
⑴ 写出A、B的结构简式 A _____________,B______________
⑵ 写出生成A的化学反应方程式____________________________________
⑶ 用方程式表示乙酸的自偶电离过程,并分析乙酸中加入B后,电导率显著提高的原因
⑷ 红外光谱显示,纯乙酸中存在两种羧羟基吸收峰,分析这两种峰产生的原因
⑸ 为什么说非水型电解质可以扩大电化学反应研究的物质范围和电位区间?
20世纪60年代,化学家发现了一类酸性比100%的硫酸还要强的酸,称之为魔酸,其酸性强至可以将质子给予δ受体,CF3SO3H就是其中常见的魔酸之一。
⑴试写出CH3CH3与CF3SO3H可能的反应式。
⑵以上反应所得产物活性均很高,立即发生分解,试写出分解以后所得到的全部可能产物。
铬的化学丰富多采,实验结果常出人意料。将过量30% H2O2加入(NH4)2CrO4的氨水溶液, 热至50oC后冷至0oC,析出暗棕红色晶体A。元素分析报告:A含Cr 31.1%,N 25.1%,H 5.4%。在极性溶剂中A不导电。红外图谱证实A 有N-H键,且与游离氨分子键能相差不太大,还证实A 中的铬原子周围有7个配位原子提供孤对电子与铬原子形成配位键,呈五角双锥构型。
3-1 以上信息表明A 的化学式为: ;可能的结构式为: 。
3-2 A 中铬的氧化数为: 。
3-3 预期A 最特征的化学性质为: 。
3-4 生成晶体A的反应是氧化还原反应,方程式是: 。
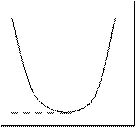
A和B两种物质互相溶解的关系如图1所示,横坐标表示体系的总组成,纵坐标为温度,由下至上,温度逐渐升高。T1时a是B在A中的饱和溶液的组成,b是A在B中的饱和溶液的组成(T2时相应为c、d)。T3为临界温度,此时A和B完全互溶。图中曲线内为两相,曲线外为一相(不饱和液)。某些物质如H2O和(C2H5)3N,C3H5(OH)3和间-CH3C6H4NH2有低的临界温度(见示意图2)。请根据上述事实,回答下列问题: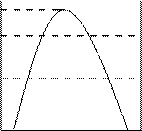

 T3
T3
 T2 c d
T2 c d
T1 a b





 18.5° C
18.5° C
A 100% 80% 60% 40% 20% 0% H2O (C2H5)3N
0% 20% 40% 60% 80% 100% B
图 1 图 2
2-1 解释图1中T3存在的原因。
2-2 说明图2所示的两对物质存在低的临界温度的原因。
2-3 描述图2所示的两对物质的互溶过程。