高考名师推荐化学--预测14
关于下列各实验装置的叙述中,不正确的是
| A.装置①可用于实验室制取少量NH3或O2 |
| B.可用从a处加水的方法检验装置②的气密性 |
| C.实验室可用装置③收集H2、NH3 |
| D.利用装置④制硫酸和氢氧化钠,其中b为阳离子交换膜、c为阴离子交换膜 |
如图所示,NaS电池是当前开发的一种高性能可充电电池,它所贮存的能量为常用铅蓄电池的5倍(按相同质量计),电池反应为
2Na(l)+S8(l) Na2Sn。下列说法不正确的是
Na2Sn。下列说法不正确的是
| A.外室熔融硫中添加石墨粉主要是为了增强导电性 |
| B.放电时Na+向正极移动 |
| C.充电时阳极反应式为8S-16e-===nS8 |
| D.充电时钠极与外接电源的正极相连 |
下列选项中的图像所表示的内容与相应反应符合的是(a、b、c、d均大于0)
A.4NH3(g)+5O2(g)  4NO(g)+6H2O(g)ΔH=-a kJ·mol-1 4NO(g)+6H2O(g)ΔH=-a kJ·mol-1 |
B.N2(g)+3H2(g)  2NH3(g) ΔH=-b kJ·mol-1 2NH3(g) ΔH=-b kJ·mol-1 |
C.2SO3(g)  2SO2(g)+O2(g) ΔH=+c kJ·mol-1 2SO2(g)+O2(g) ΔH=+c kJ·mol-1 |
D.2N2O5(g)  4NO2(g)+O2(g) ΔH=+d kJ·mol-1 4NO2(g)+O2(g) ΔH=+d kJ·mol-1 |
下表所列各组物质中,不能通过一步反应实现如图所示转化的是
| 物质 选项 |
a |
b |
c |
| A |
Si |
Na2SiO3 |
SiO2 |
| B |
Fe |
FeCl3 |
FeCl2 |
| C |
AlCl3 |
Al(OH)3 |
NaAlO2 |
| D |
Na2O2 |
Na2CO3 |
NaOH |
下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是
| A.Z、N两种元素的离子半径相比,前者较大 |
| B.X、N两种元素的气态氢化物的沸点相比,前者较低 |
| C.由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
| D.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液 |
常温下,下列各组离子在指定的溶液中可能大量共存的是
| A.无色透明溶液中:Al3+、Ca2+、Cl-、HCO3- |
| B.含大量Fe3+的溶液中:K+、I-、SO42-、NO3- |
| C.与Al反应放出H2的溶液中:NH4+、Na+、NO3-、F- |
| D.由水电离出的c(H+)=1.0×10-14 mol·L-1的溶液中:Mg2+、K+、Cl-、SO42- |
设NA为阿伏加德罗常数的值。下列叙述正确的是
| A.在标况下, 11.2 L NO与11.2 L O2混合后所含分子数为0.75NA |
| B.常温常压下,16 g O3所含的电子数为8NA |
| C.0.1 mol Na2O2晶体中含有0.4NA个离子 |
| D.铝跟氢氧化钠溶液反应生成1 mol氢气时,转移的电子数为NA |
A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为40,B、W同周期,D、E同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素的盐酸盐或硫酸盐可以用来净水,原理是_______________________(文字表述)。
(2)A2W2的分子中所含的化学键为________、________,经测定A2W2为二元弱酸,其酸性比碳酸的还要弱,请写出其第一步电离的电离方程式___________。
(3)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式____________________。
(4)元素D的单质在一定条件下,能与A单质化合生成一种氢化物DA,熔点为800℃,DA能与水反应放氢气,若将1 mol DA和1 mol E单质混合加入足量的水,充分反应后生成气体的体积是__________________(标准状况下)。
(5)D的某化合物呈淡黄色,可与氯化亚铁溶液反应。若淡黄色固体与氯化亚铁反应的物质的量之比为1∶2,且无气体生成,则该反应的离子方程式为____________________。
(6)在常温下用气体密度测定BW2的相对分子质量,实验值比理论值偏________(填 “高”或“低”),其原因是___________________。
常温下,用0.1000 mol/L NaOH溶液分别滴定20.00mL 0.1000 mol/L盐酸和20.00 mL 0.1000 mol/L醋酸溶液,得到2条滴定曲线(如下图所示)以HA表示酸,下列说法正确的是( )
A、滴定盐酸的曲线是图2
B、达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A-)
C、达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
D、当0mL< V(NaOH)<20.00mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A-)>c(Na+)>c(H+)>c(OH-)
下列化学用语表述正确的是( )
A.CH3COONH4的电离方程式为: CH3COONH4 CH3COO-+NH4+ CH3COO-+NH4+ |
B.NaHS的水解方程式为: HS-+H2O S2-+H3O+ S2-+H3O+ |
| C.用过量的氨水吸收SO2的离子方程式为: 2NH3·H2O+SO2=2NH4++SO32-+H2O |
| D.过量Fe粉与Cl2反应的化学方程式为: Fe +Cl2FeCl2 |
相对分子质量为100的有机物A能与钠反应,且完全燃烧只生成CO2和H2O。若A含一个六碳环,则环上一氯代物的数目为( )
| A.5 | B.4 | C.3 | D.2 |
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是( )
| A.原子半径:W>Z>Y>X>M |
| B.XZ2、X2M2、W2Z2均为直线型的共价化合物 |
| C.由X元素形成的单质不一定是原子晶体 |
| D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
下列关于氯水的说法正确的是( )
| A.向氯水中通入少量二氧化硫,氯水的漂白性增强 |
| B.氯水中加入NaCl固体,对溶液的pH无影响 |
| C.常温下,pH=2的氯水中:c(Cl-)+c(ClO-)+c(OH-)=0.01mol/L |
| D.向氯水中滴加少量NaHCO3溶液的离子反应方程式为:Cl2+2HCO3-=2CO2↑+Cl-+ClO-+H2O |
下列条件下,离子能大量共存或者离子方程式正确的是( )
| A.pH=1的溶液中:Fe2+、ClO-、Na+、SO42- |
| B.在含较多Al3+的溶液中:K+、Cl-、HCO3- |
| C.一小块钠投入到CuSO4溶液中:2Na+Cu2+= Cu+2Na+ |
| D.铜溶于稀硝酸:3Cu + 8H+ + 2NO3- = 3Cu2++ 2NO↑+ 4H2O |
下列说法正确的是( )
| A.煤的液化和气化都是物理变化 |
| B.乙醇、乙酸和甲醛广泛应用于食品加工 |
| C.蛋白质、橡胶和塑料都是天然高分子 |
| D.高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 |
【物质结构与性质】
天冬酰胺(结构如右图)在芦笋中含量丰富,具有提高身体免疫力的功效。
(1)天冬酰胺所含元素中 (填元素名称)元素基态原子核外未成对电子数最多,天冬酰胺中碳原子的杂化轨道类型有 种。
(2)H2S和H2Se的参数对比见下表。
| 化学式 |
键长/nm |
键角 |
沸点/℃ |
| H2S |
1.34 |
92.3o |
一60.75 |
| H2Se |
1.47 |
91.0o |
一41.50 |
①H2Se的晶体类型为 ,含有的共价键类型为 。
②H2S的键角大于H2Se的原因可能为 。
(3)已知钼(Mo)位于第五周期VIB族,钼、铬、锰的部分电离能如下表所示
| 编号 |
I5/kJ·mol-1 |
I6/kJ·mol-1 |
I7/kJ·mol-1 |
I8/kJ·mol-1 |
| A |
6990 |
9220 |
11500 |
18770 |
| B |
6702 |
8745 |
15455 |
17820 |
| C |
5257 |
6641 |
12125 |
13860 |
A是 (填元素符号),B的价电子排布式为 。
【化学与技术】
下图是某企业设计的硫酸—磷肥—水泥联产、海水—淡水多用、盐—热—电联产的三大生态产业链流程图。
根据上述产业流程回答下列问题:
(1)该流程①、②、③、④、⑤为能量或物质的输送,请分别写出输送的主要物质的化学式或能量形式:① 、② 、③ 、④ 、⑤ 。
(2)沸腾炉发生反应的化学方程式 。磷肥厂的主要产品是普钙(磷酸二氢钙和硫酸钙),写出由磷矿石和硫酸反应制普钙得化学方程式 。
(3)用1吨硫铁矿(FeS2的质量分数为36%)接触法制硫酸,制硫酸的产率为65%,则最后能生产出质量分数为98%的硫酸 吨。
(4)热电厂的冷却水是 ,该流程中浓缩盐水除提取盐以外还可提取的物质有 (写出一种即可)。
(5)根据现代化工厂设计理念请提出高炉炼铁厂废气、废渣及多余热能的利用设想。 , (写出两点即可)。
碱式碳酸铜和氯气都是用途广泛的化工原料。
(1)工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl−)制备碱式碳酸铜,其制备过程如下: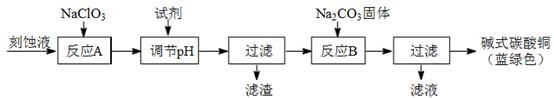
已知:Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物质 |
Cu(OH)2 |
Fe (OH)2 |
Fe (OH)3 |
| 开始沉淀pH |
4.2 |
5.8 |
1.2 |
| 完全沉淀pH |
6.7 |
8.3 |
3.2 |
①氯酸钠的作用是 ;
②反应A后调节溶液的pH范围应为 。
③第一次过滤得到的产品洗涤时,如何判断已经洗净? 。
④造成蓝绿色产品中混有CuO杂质的原因是 。
(2)某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。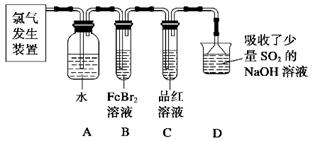
①实验室用二氧化锰和浓盐酸加热制取氯气,所用仪器需要检漏有 。
②若C中品红溶液褪色,能否证明氯气与水反应的产物有漂白性,说明原因 。此时B装置中发生反应的离子方程式是 。
③写出A溶液中具有强氧化性微粒的化学式 。若向A溶液中加入NaHCO3粉末,会观察到的现象是 。
苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸(KMnO4中性条件下还原产物为MnO2,酸性条件下为Mn2+)
已知:苯甲酸相对分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3 g和6.9 g。
实验流程:
①往装置A中加入2.7mL(2.3 g)甲苯和125 mL水,然后分批次加入8.5 g稍过量的KMnO4固体,控制反应温度约在100℃,当甲苯层近乎消失,回流不再出现油珠时,停止加热。
②将反应混合物趁热过滤,用少量热水洗涤滤渣,合并滤液与洗涤液,冷却后加入浓盐酸,经操作I得白色较干燥粗产品。
③纯度测定:称取1.220g白色样品,配成100mL,甲醇溶液,取25.00mL溶液,用0.1000mol/L KOH标准溶液滴定,重复滴定四次,每次消耗的体积如下表所示列举:
| |
第一次 |
第二次 |
第三次 |
第四次 |
| 体积(mL) |
24.00 |
24.10 |
22.40 |
23.90 |
请回答:
(1)装置A的名称 。若不用温度计,本实验控制反应温度的措施为 。
(2)白色粗产品中除了KCl外,其他可能的无机杂质为 。
(3)操作I的名称 。
(4)步骤③中用到的定量仪器有 ,100mL容量瓶,50mL酸式、碱式滴定管。
(5)样品中苯甲酸纯度为 。
(6)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则测定结果 (填“偏大”、“偏小”或“不变”)。
丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。已知:
①2C3H8(g)+7O2(g) =6CO(g)+8H2O(g) △H =-2389.8 kJ/mol
②2CO(g) + O2(g) =2CO2(g) △H =-566 kJ/mol
③H2O(l) = H2O(g) △H ="+" 44.0 kJ/mol
(1)写出C3H8燃烧时燃烧热的热化学方程式 。
(2)C3H8在不足量的氧气里燃烧,生成CO、CO2、H2O(g),将所有的产物通入一个体积固定的密闭容器中,在一定条件下发生如下可逆反应:CO(g) +H2O(g)  CO2(g) +H2(g)该反应的平衡常数与温度的关系如下表:
CO2(g) +H2(g)该反应的平衡常数与温度的关系如下表:
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数K |
9.94 |
9 |
1 |
保持温度为800℃,在甲、乙两个恒容密闭容器中,起始时按照下表数据进行投料,充分反应直至达到平衡。
| |
H2O |
CO |
CO2 |
H2 |
| 甲 (质量/g) |
1.8 |
8.4 |
a |
1 |
| 乙 (质量/g) |
1.8 |
2.8 |
0 |
0 |
①起始时,要使甲容器中反应向正反应方向进行,则a的取值范围是 ;达到平衡时,乙容器中CO的转化率为 。
②下图表示上述甲容器中反应在t1时刻达到平衡,在t2时刻因改变某一个条件而发生变化的情况。则t2时刻改变的条件可能是 、 (答两个要点即可)。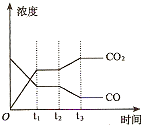
(3)CO2可用NaOH溶液吸收得到Na2CO3或NaHCO3。
① Na2CO3溶液中离子浓度由大到小的顺序为 ;
② 已知25℃时,H2CO3的电离平衡常数K1 = 4.4×10-7 mol/L、K2 = 4.7×10-11 mol/L,当Na2CO3溶液的pH为11时,溶液中c(HCO3-)∶c(CO32-) = 。
③ 0.1 mol/L Na2CO3溶液中c(OH-) -c(H+) = [用含c(HCO3-)、c(H2CO3)的符号表示]。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号