下列过程中,属于放热反应的有( )
①石油液化气燃烧 ②碳酸钙分解 ③硝酸铵溶于水 ④铁与氧气反应
| A.①③ | B.①④ | C.②③ | D.②④ |
(12分)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(图中的ΔH表示生成1 mol产物的数据)。
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是
________________________________________________________________________;
(2)PCl5分解成PCl3和Cl2的热化学方程式是
________________________________________________________________________。
上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80 mol PCl5,反应达平衡时PCl5还剩0.60 mol,其分解率α1等于________;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2________α1(填“大于”、“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是____________________________________________________
________________________________________________________________________
____________________________________________________________________;
(4)P和Cl2分两步反应生成1 mol PCl5的ΔH3=________,P和Cl2一步反应生成1 mol PCl5的ΔH4______ΔH3(填“大于”、“小于”或“等于”);
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是_________________________________。
在2 L密闭容器中放入CO(g)、H2O(g)各1 mol,发生CO(g) + H2O(g) = CO2(g) + H2(g)反应(正反应为放热反应),改变下列条件,不能使V正 增大的是
| A.升高温度 | B.降低温度 |
| C.使用催化剂 | D.压缩容器,使其体积变为1 L |
下列说法正确的是( )
| A.甲烷的标准燃烧热为-890.3KJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3KJ·mol-1 |
| B.500oC,30Mpa下,将0.5molN2和1.5H2置于密闭的容器中充分反应生成NH3(g),放热19.3KJ,其热化学方程式为: N2(g)+3H2(g) 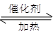 2NH3(g)△H=-38.6KJ·mol-1 2NH3(g)△H=-38.6KJ·mol-1 |
| C.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H﹥0 |
| D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的△H不同 |
下列说法不正确的是
| A.热化学方程式需注明物质的状态 |
| B.能源是能提供能量的资源 |
| C.化石燃料取之不尽,用之不竭 |
| D.反应热包括燃烧热、中和热等 |
已知在1×105Pa、298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
A.H2O(g)=H2(g)+ O2(g); O2(g); H= -242kJ·mol-1 H= -242kJ·mol-1 |
B.2H2(g)+O2(g)=2H2O(l); H= -484kJ·mol-1 H= -484kJ·mol-1 |
C.H2(g)+ O2(g)=H2O(g); O2(g)=H2O(g); H= +242kJ·mol-1 H= +242kJ·mol-1 |
D.2H2(g)+O2(g)=2H2O(g); H= -484kJ·mol-1 H= -484kJ·mol-1 |
(8分).处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S(g)。发生反应为:
(1)已知:CO(g)+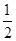 O2(g)=CO2(g) △H=-283.0kJ·mol—1
O2(g)=CO2(g) △H=-283.0kJ·mol—1
S(g)+O2(g)=SO2(g) △H=" -" 296.0 kJ·mol—1
试写出利用上述方法处理烟道气的热化学方程式
(2)在容积为2L的密闭容器中,充入4molCO和2molSO2,在一定条件下发生反应2CO(g)+SO2(g) S(g)+2CO2(g),CO2的物质的量分数随时间的变化如图所示,则:
S(g)+2CO2(g),CO2的物质的量分数随时间的变化如图所示,则: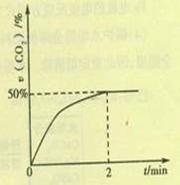
①0-2min内的平均反应速率v(CO)= 。
②该温度下,上述反应的平衡常数K= (填数值)。
③2min后改变下列条件能使上述反应的反应速率增大,且平衡向正向移动的是
a.选用更高效的催化剂 b.升高温度 c.及时分离出二氧化碳 d.增加SO2的浓度
下列热化学方程式中△H代表燃烧热的是( )
| A.CH4(g)+ 3/2O2 (g)= 2H2O(l)+ CO(g)△H1 |
| B.S(s)+ 3/2O2(g)= SO3(s) △H2 |
| C.C6H12O6(s)+ 6O2(g )= 6CO2(g)+ 6H2O(l)△H3 |
| D.2CO(g)+ O2 (g) = 2CO2(g) △H4 |
下列反应中生成物总能量高于反应物总能量的是
| A.碳酸钙受热分解 | B.钠与水反应 |
| C.铝粉与氧化铁粉末反应 | D.氧化钙溶于水 |
由金红石(TiO2)制取单质Ti,涉及到的部分步骤为:
TiO2 TiCl4
TiCl4 Ti
Ti
已知:① C(s)+O2(g)=CO2(g) DH1
② 2CO(g)+O2(g)=2CO2(g) DH2
③ TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) DH3
则反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的DH为
| A.DH3 +2DH1-2DH2 | B.DH3 +DH1-DH2 |
| C.DH3 +2DH1-DH2 | D.DH3 +DH1-2DH2 |
25 ℃时,合成氨反应的热化学方程式为:
N2(g)+3H2(g) 2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol
在该温度时,取2mol N2和7 mol H2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是[ ]
| A.92.4 kJ | B.92.4 kJ ~184.8 kJ |
| C.小于184.8 kJ | D.184.8 kJ |
由化学能产生的能量是目前人类使用的主要能源。请回答下列问题:
(1)N2和O2在一定条件下反应生成NO2的热化学方程式为: N2(g)+O2(g)====NO2(g) ΔH=+34 kJ·mol-1。该反应为_____________(“放热”“吸热”)反应。
N2(g)+O2(g)====NO2(g) ΔH=+34 kJ·mol-1。该反应为_____________(“放热”“吸热”)反应。
(2)化学反应中的能量变化源自于化学反应中化学键变化时产生的能量变化。下表为一些化学键的键能:
| 化学键 |
键能( kJ·mol-1) |
化学键 |
键能( kJ·mol-1) |
| N≡N |
942 |
H—O |
460 |
| N—H |
391 |
O==O |
499 |
| H—H |
437 |
|
|
①写出N2和H2反应合成氨的热化学方程式_________________________。
②已知:1 mol H2O(g)转化为1 mol H2O(l)时放出44.0 kJ的热量。计算1 g H2完全燃烧时放出的热量___________________。H2O(g)的稳定性___________(“大于”“小于”)H2O(l)。
(3)写出NH3(g)在O2(g)中完全燃烧生成NO2(g)和H2O(g)的热化学方程式_________________________________________________________________________。
中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中不正确的是
| A.用反应物、产物中键能数据可判断对应反应的反应热 |
| B.用沸点数据推测将一些液体混合物用分镏的方法分离开来的可能性 |
| C.用反应热数据的大小判断不同反应的反应速率的快慢 |
| D.用平衡时各组分的物质的量浓度可计算一定温度下反应的平衡常数 |