已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是285.8kJ·mol-1、1411.0kJ·mol-1和1366.8 kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为
| A.-44.2 kJ·mol-1 | B.+44.2 kJ·mol-1 | C.-330 kJ·mol-1 | D.+330 kJ·mol-1 |
氢气、碳、辛烷、甲烷的热化学方程式分别为:2H2(g)+O2(g)2H2O(l) ΔH=-571.6 kJ·mol-1 C(s)+1/2 O2(g)====CO(g) ΔH=-110.5 kJ·mol-1
C8H18(l)+25/2O2(g)====8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
CH4(g)+2O2(g)====CO2(g)+2H2O(g) ΔH=-802.3 kJ·mol-1其中反应热能表示该物质燃烧热的是
| A.氢气 | B.碳 | C.辛烷 | D.甲烷 |
由化学能产生的能量是目前人类使用的主要能源。请回答下列问题:
(1)N2和O2在一定条件下反应生成NO2的热化学方程式为: N2(g)+O2(g)====NO2(g) ΔH=+34 kJ·mol-1。该反应为_____________(“放热”“吸热”)反应。
N2(g)+O2(g)====NO2(g) ΔH=+34 kJ·mol-1。该反应为_____________(“放热”“吸热”)反应。
(2)化学反应中的能量变化源自于化学反应中化学键变化时产生的能量变化。下表为一些化学键的键能:
| 化学键 |
键能( kJ·mol-1) |
化学键 |
键能( kJ·mol-1) |
| N≡N |
942 |
H—O |
460 |
| N—H |
391 |
O==O |
499 |
| H—H |
437 |
|
|
①写出N2和H2反应合成氨的热化学方程式_________________________。
②已知:1 mol H2O(g)转化为1 mol H2O(l)时放出44.0 kJ的热量。计算1 g H2完全燃烧时放出的热量___________________。H2O(g)的稳定性___________(“大于”“小于”)H2O(l)。
(3)写出NH3(g)在O2(g)中完全燃烧生成NO2(g)和H2O(g)的热化学方程式_________________________________________________________________________。
已知下列热化学方程式:
①H2(g)+1/2O2(g)====H2O(l) ΔH=-285.8 kJ·mol-1
②H2(g)+1/2O2(g)====H2O(g) ΔH=-241.8 kJ·mol-1
③C(s)+1/2 O2(g)====CO(g) ΔH=-110.5 kJ·mol-1
④C(s)+O2(g)====CO2(g) ΔH=-393.5 kJ·mol-1
完成下列问题:
(1)上述反应中属于放热反应的是________________。
(2)H2的燃烧热为________________;C的燃烧热为________________。
(3)燃烧10 g H2生成液态水,放出的热量为________________。
(4)CO的燃烧热为________________;其热化学方程式为_______________________。
下列有关能量的叙述错误的是
| A.化石能源物质内部蕴涵着大量的能量 |
| B.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来 |
| C.吸热反应中由于反应物总能量小于生成物总能量,因而没有利用价值 |
| D.物质的化学能可以在一定条件下转化为热能、电能为人类所利用 |
灰锡(以粉末状存在)和白锡是锡元素的两种不同单质。已知在温度低于13.2 ℃时白锡转化为灰锡,转化过程的能量变化如右图所示,则下列说法正确的是
| A.完全燃烧等质量白锡和灰锡,灰锡放出的热量更多 |
| B.锡在常温下以灰锡状态存在 |
| C.白锡转化为灰锡的反应为吸热反应 |
| D.白锡制造的器皿长期处于低于13.2 ℃的环境中,会自行毁灭 |
下列说法不正确的是( )
| A.元素的第一电离能(I1)是元素的单质失去最外层1个电子所需要吸收的能量,同周期从左到右元素的I1逐渐增大 |
| B.元素的电负性是衡量元素在化合物中吸引电子能力大小的一种标度,同主族从上到下元素的电负性逐渐减小 |
| C.含有阴离子的晶体中一定含有阳离子,含有阳离子的晶体中不一定含有阴离子 |
| D.原子晶体中一定含有共价键;离子晶体中一定含有离子键,可能含有共价键;分子晶体中一定存在分子间作用力 |
家用液化气的主要成分是丙烷、丁烷、丙烯等,将0.112 m3(标准状况下)丙烷气体完全燃烧,生成二氧化碳气体和液态水,放出11 089 kJ热量,表示上述反应的热化学方程式正确的是
| A.C3H8(g)+5O2(g)====3CO2(g)+4H2O(l) ΔH=-11 089 kJ·mol-1 |
| B.C3H8(g)+5O2(g)====3CO2(g)+4H2O(l) ΔH=+2 217.8 kJ·mol-1 |
| C.C3H8(g)+5O2(g)====3CO2(g)+4H2O(l) ΔH=+11 089 kJ·mol-1 |
| D.C3H8(g)+5O2(g)====3CO2(g)+4H2O(l) ΔH=-2 217.8 kJ·mol-1 |
(8分).处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S(g)。发生反应为:
(1)已知:CO(g)+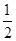 O2(g)=CO2(g) △H=-283.0kJ·mol—1
O2(g)=CO2(g) △H=-283.0kJ·mol—1
S(g)+O2(g)=SO2(g) △H=" -" 296.0 kJ·mol—1
试写出利用上述方法处理烟道气的热化学方程式
(2)在容积为2L的密闭容器中,充入4molCO和2molSO2,在一定条件下发生反应2CO(g)+SO2(g) S(g)+2CO2(g),CO2的物质的量分数随时间的变化如图所示,则:
S(g)+2CO2(g),CO2的物质的量分数随时间的变化如图所示,则: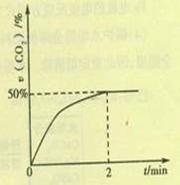
①0-2min内的平均反应速率v(CO)= 。
②该温度下,上述反应的平衡常数K= (填数值)。
③2min后改变下列条件能使上述反应的反应速率增大,且平衡向正向移动的是
a.选用更高效的催化剂 b.升高温度 c.及时分离出二氧化碳 d.增加SO2的浓度
下列说法正确的是( )
| A.甲烷的标准燃烧热为-890.3KJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3KJ·mol-1 |
| B.500oC,30Mpa下,将0.5molN2和1.5H2置于密闭的容器中充分反应生成NH3(g),放热19.3KJ,其热化学方程式为: N2(g)+3H2(g) 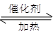 2NH3(g)△H=-38.6KJ·mol-1 2NH3(g)△H=-38.6KJ·mol-1 |
| C.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H﹥0 |
| D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的△H不同 |
已知在1×105Pa、298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
A.H2O(g)=H2(g)+ O2(g); O2(g); H= -242kJ·mol-1 H= -242kJ·mol-1 |
B.2H2(g)+O2(g)=2H2O(l); H= -484kJ·mol-1 H= -484kJ·mol-1 |
C.H2(g)+ O2(g)=H2O(g); O2(g)=H2O(g); H= +242kJ·mol-1 H= +242kJ·mol-1 |
D.2H2(g)+O2(g)=2H2O(g); H= -484kJ·mol-1 H= -484kJ·mol-1 |
甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时放出222.5kJ热量,则下列热化学方程式中正确的是( )
| A.CH4(g) + 2O2(g) ="=" CO2(g) +2H2O(l) ΔH=-890 kJ·mol-1 |
| B.2CH4(g) + 4O2(g) ="=" 2CO2(g) + 4H2O(l) ΔH= +890 kJ·mol-1 |
| C.CH4(g) + 2O2(g) ="=" CO2(g) +2H2O(l) ΔH= +890 kJ·mol-1 |
| D.2CH4(g) + 4O2(g) ="=" 2CO2(g) + 4H2O(l) ΔH= -890 kJ·mol-1 |
已知化学反应A2(g) + B2(g) ="==" 2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
A.每生成2分子AB吸收bkJ热量
B. 该反应热△H=+(a-b)kJ/mol
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂1molA—A和1molB—B键,放出akJ能量
.根据下表中所列键能数据,判断下列分子中,最不稳定的分子是
| 化学键 |
H—H |
H—Cl |
H—I |
Cl—Cl |
Br—Br |
| 键能/ kJ/mol |
436 |
431 |
299 |
247 |
193 |
A. B.
B. C.
C. D.
D.
近20年来,对于氢能源的研究获得了迅速发展,像电一样,氢是一种需要依靠其他能源如石油、煤、太阳能等的能量来制取的所谓的“二级能源”,而存在于自然界的可以提供现成形式能量的能源称为一级能源,如煤、石油、太阳能和原子能等。
(1)为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济且资源可持续利用的制氢气的方法是_______________。
| A.电解水 | B.锌和稀硫酸反应 |
| C.光解海水 | D.以石油、天然气为原料 |
(2)氢气燃烧时耗氧量小,发热量大。已知碳和氢气燃烧的热化学方程式为:
C(s)+O2(g)====CO2(g) ΔH=-393.5 kJ·mol-1
H2(g)+1/2O2(g)====H2O(l) ΔH=-285.8 kJ·mol-1
试通过计算说明等质量的氢气和碳燃烧时产生热量的比是_______________。
(3)氢能源有可能实现能源的贮存,也可能实现经济、高效的输送。研究表明过渡金属的氢化物(又称间充氢化物)中,氢原子填充在金属的晶格间隙之间时,其组成不固定,通常是非化学计量的,如LaH2.76、TiH1.73、Ce H2.69。已知标准状况下,1体积的钯粉大约可吸附896体积的氢气(钯粉的密度为10.64 g·cm-3,相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式_________________。