在2 L密闭容器中放入CO(g)、H2O(g)各1 mol,发生CO(g) + H2O(g) = CO2(g) + H2(g)反应(正反应为放热反应),改变下列条件,不能使V正 增大的是
| A.升高温度 | B.降低温度 |
| C.使用催化剂 | D.压缩容器,使其体积变为1 L |
下列说法正确的是( )
| A.甲烷的标准燃烧热为-890.3KJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3KJ·mol-1 |
| B.500oC,30Mpa下,将0.5molN2和1.5H2置于密闭的容器中充分反应生成NH3(g),放热19.3KJ,其热化学方程式为: N2(g)+3H2(g)  2NH3(g)△H=-38.6KJ·mol-1 2NH3(g)△H=-38.6KJ·mol-1 |
| C.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H﹥0 |
| D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的△H不同 |
(8分).处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S(g)。发生反应为:
(1)已知:CO(g)+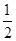 O2(g)=CO2(g) △H=-283.0kJ·mol—1
O2(g)=CO2(g) △H=-283.0kJ·mol—1
S(g)+O2(g)=SO2(g) △H=" -" 296.0 kJ·mol—1
试写出利用上述方法处理烟道气的热化学方程式
(2)在容积为2L的密闭容器中,充入4molCO和2molSO2,在一定条件下发生反应2CO(g)+SO2(g) S(g)+2CO2(g),CO2的物质的量分数随时间的变化如图所示,则:
S(g)+2CO2(g),CO2的物质的量分数随时间的变化如图所示,则: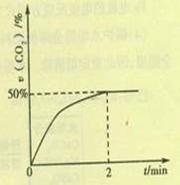
①0-2min内的平均反应速率v(CO)= 。
②该温度下,上述反应的平衡常数K= (填数值)。
③2min后改变下列条件能使上述反应的反应速率增大,且平衡向正向移动的是
a.选用更高效的催化剂 b.升高温度 c.及时分离出二氧化碳 d.增加SO2的浓度
已知在1×105Pa、298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
A.H2O(g)=H2(g)+ O2(g); O2(g); H= -242kJ·mol-1 H= -242kJ·mol-1 |
B.2H2(g)+O2(g)=2H2O(l); H= -484kJ·mol-1 H= -484kJ·mol-1 |
C.H2(g)+ O2(g)=H2O(g); O2(g)=H2O(g); H= +242kJ·mol-1 H= +242kJ·mol-1 |
D.2H2(g)+O2(g)=2H2O(g); H= -484kJ·mol-1 H= -484kJ·mol-1 |
Ⅰ、恒温、恒压下,在一个可变容积的容器中发生如下反应: N2(g)+3H2(g) 2NH3(g); △H<0
2NH3(g); △H<0
(1)工业生产中,该反应通常在高压下进行反应,做出此选择的理由是:
① ;
② 。
(2)开始时放入1mol N2和3mol H2,到达平衡后,生成amol NH3,若开始时放入χmol N2、3mol H2和y mol NH3,到达平衡后,NH3的物质的量为 3amol,则x= mol,y= mol。
Ⅱ、若该容器恒压、绝热(与外界不发生热交换),在一个与(2)反应前起始条件完全相同的容器中发生上述反应
(3)若开始时放入1mol N2和3mol H2,到达平衡后,生成b mol NH3,将b与(2)小题中的a进行比较 (选填一个编号)
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
作出此判断的理由是 。
Ⅲ、某研究性学习小组为探究利用电化学原理合成氨,设计如图所示的装置,
(4)电极B为 极
(5)电极A发生的电极反应式为
(6)该电池工作一段时间后,电解质溶液pH
(填增大、减小或不变)
(12分)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(图中的ΔH表示生成1 mol产物的数据)。
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是
________________________________________________________________________;
(2)PCl5分解成PCl3和Cl2的热化学方程式是
________________________________________________________________________。
上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80 mol PCl5,反应达平衡时PCl5还剩0.60 mol,其分解率α1等于________;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2________α1(填“大于”、“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是____________________________________________________
________________________________________________________________________
____________________________________________________________________;
(4)P和Cl2分两步反应生成1 mol PCl5的ΔH3=________,P和Cl2一步反应生成1 mol PCl5的ΔH4______ΔH3(填“大于”、“小于”或“等于”);
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是_________________________________。
下列热化学方程式中△H代表燃烧热的是( )
| A.CH4(g)+ 3/2O2 (g)= 2H2O(l)+ CO(g)△H1 |
| B.S(s)+ 3/2O2(g)= SO3(s) △H2 |
| C.C6H12O6(s)+ 6O2(g )= 6CO2(g)+ 6H2O(l)△H3 |
| D.2CO(g)+ O2 (g) = 2CO2(g) △H4 |
已知化学反应A2(g) + B2(g) ="==" 2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
A.每生成2分子AB吸收bkJ热量
B. 该反应热△H=+(a-b)kJ/mol
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂1molA—A和1molB—B键,放出akJ能量
下列反应中生成物总能量高于反应物总能量的是
| A.碳酸钙受热分解 | B.钠与水反应 |
| C.铝粉与氧化铁粉末反应 | D.氧化钙溶于水 |
下列说法不正确的是
| A.对电池充电是将电能转化为化学能的过程 |
| B.吸热反应中反应物化学键断裂所吸收的热量大于生成物中化学键形成所放出的热量 |
| C.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程 |
| D.植物通过光合作用将太阳能转变成化学能 |
由金红石(TiO2)制取单质Ti,涉及到的部分步骤为:
TiO2 TiCl4
TiCl4 Ti
Ti
已知:① C(s)+O2(g)=CO2(g) DH1
② 2CO(g)+O2(g)=2CO2(g) DH2
③ TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) DH3
则反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的DH为
| A.DH3 +2DH1-2DH2 | B.DH3 +DH1-DH2 |
| C.DH3 +2DH1-DH2 | D.DH3 +DH1-2DH2 |
下列说法不正确的是
| A.热化学方程式需注明物质的状态 |
| B.能源是能提供能量的资源 |
| C.化石燃料取之不尽,用之不竭 |
| D.反应热包括燃烧热、中和热等 |
25 ℃时,合成氨反应的热化学方程式为:
N2(g)+3H2(g) 2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol
在该温度时,取2mol N2和7 mol H2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是[ ]
| A.92.4 kJ | B.92.4 kJ ~184.8 kJ |
| C.小于184.8 kJ | D.184.8 kJ |
下列对化学反应热现象的说法正确的是[ ]
| A.放热反应发生时都不必加热 |
| B.化学反应中一定有能量变化 |
| C.一般地说,吸热反应加热后才能发生 |
| D.化学反应的热效应数值与参加反应的物质的多少无关 |