2005年10月12日我国成功发射了第二艘载人航天飞船——“神舟六号”,实现了双人多天太空旅行,这标志着中国人的太空时代又向前迈进了一大步。发射“神六”时用肼 (N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。
已知:N2(g)+2O2(g)==2NO2(g);△H=+67.7kJ/mol
N2H4(g)+O2(g)==N2(g)+2H2O(g);△H=-534kJ/tool
下列关于肼和NO2反应的热化学方程式中,正确的是
| A.2N2H4(g)+2NO2(g)==3N2(g)+4H2O(1);AH=-1135.7kJ/mol |
| B.2N2H4(g)+2NO2(g)==3N2(g)+4H2O(g);△H=-1000.3kJ/mol |
| C.N2H4(g)+NO2(g)==3/2N2(g)+2H2O(1);△H=-1135.7kJ/mol |
| D.2N2H4(g)+2NO2(g)==3N2(g)+4H2O(g);△H=-1135.7kJ/mol |
参照反应Br + H2 HBr +H的能量对反应历程的示意图,下列对上述正反应叙述中正确的 ( )
HBr +H的能量对反应历程的示意图,下列对上述正反应叙述中正确的 ( )

| A.反应热:过程I>过程Ⅱ |
| B.反应速率:过程Ⅱ=过程I |
| C.该反应为吸热反应 |
| D.过程I使用了催化剂 |
(12分)2008年9月25日我国“神七”成功发射,标志着我国载人航天技术迈出重要的一步。“神七”以N2H4和N2O4燃料,N2H4学名为肼又称联氨,无色油状液体,具有与氨相似的气味,毒性很大。
⑴水电离成H3O+和OH-叫做水的自偶电离。同水一样,N2H4也有微弱的自偶电离,其自偶电离的方程式为: 。
⑵氨显碱性的原因在于NH3分子中的N原子具有孤对电子,它能通过配位键结合水中的H+,使水电离出OH-,其过程可以表示为NH3+H2O NH4++OH-。试问N2H4与足量盐酸反应的化学方程式: 。
NH4++OH-。试问N2H4与足量盐酸反应的化学方程式: 。
⑶已知硼酸[B(OH)3]为一元弱酸,其显示酸性的原理与NH3、N2H4显示碱性的原理类似,试用离子方程式表示其显示酸性的过程: 。
⑷N2H4和N2O4反应温度达2700摄氏度,产生无污染的气体。1g液态N2H4与足量的液态N2O4充分反应生成两种气态物质,可放出a KJ热量,试写出该反应的热化学方程式:
。
已知、
和
的燃烧热分别是-285.8
,-1411.0
和-1366.8
,则由
和
反应生成
的
为()
| A. |
-44.2
|
B. |
+44.2
|
| C. |
-330
|
D. |
+330
|
白磷与氧可发生如下反应:。已知断裂下列化学键需要吸收的能量分别为:
、
、
、
。

根据图示的分子结构和有关数据估算该反应的△,其中正确的是( )
| A. |
|
| B. |
|
| C. |
|
| D. |
|
下列有关能量转换的说法正确的是( )
| A. | 煤燃烧是化学能转化为热能的过程 |
| B. | 化石燃料和植物燃料燃烧时放出的能量均来源于太阳能 |
| C. |
动物体内葡萄糖被氧化成
|
| D. |
植物通过光合作用将
|
北京奥运会"祥云"火炬燃料是丙烷,亚特兰大奥运会火炬燃料是丙烯
。
(1)丙烷脱氢可得丙烯。
已知:
+
≡
+
;△
="156.6"
-1
=

+
=
;△
="32.4"
-1
则相同条件下,反应
=
+
的△
=
-1
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入和
,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为;放电时,
2-移向电池的(填"正"或"负")极。
(3)碳氢化合物完全燃烧生成和
。常温常压下,空气中的
溶于水,达到平衡时,溶液的
=5.60,
(
)=1.5×10-5
-1。若忽略水的电离及
的第二级电离,则
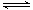
- +
+的平衡常数
=。(已知:10-5.60=2.5×10-6)
(4)常温下,则溶液(
)
(
-)(填">"、"="或"<"),原因是(用离子方程式和必要的文字说明)。
已知:,下列说法正确的是()
| A. |
2
|
| B. |
1
|
| C. |
在相同条件下,1
|
| D. |
1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270
|
红磷和
发生反应生成
和
。反应过程和能量关系如图所示(图中的
表示生成1
产物的数据)。

根据上图回答下列问题:
(1)和
反应生成
的热化学方程式。
(2)分解成
和
的热化学方程式,上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80
,反应达到平衡时
还剩0.60
,其分解率
等于;若反应温度由
升高到
,平衡时
的分解率为
,
(填"大于"、"小于"或"等于")。
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物,然后降温,再和
反应生成
。原因是。
(4)和
分两步反应生成1
的
=,
和
一步反应生成1
的
(填"大于"、"小于"或"等于")。
(5)与足量水充分反应,最终生成两种酸,其化学方程式是。
已知: ΔΗ=234.1kJ·mol-1
ΔΗ=-393.5 kJ·mol-1
则 的ΔΗ是()
| A. | -824.4 kJ·mol -1 | B. | -627.6 kJ·mol -1 |
| C. | -744.7 kJ·mol -1 | D. | -169.4 kJ·mol -1 |
右图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混和,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块是
| A. | 硝酸铵 | B. | 生石灰 |
| C. | 氯化镁 | D. | 食盐 |
下列叙述不正确的是()
| A. | 铁表面镀锌,铁作阳极 |
| B. | 船底镶嵌锌块,锌作负极,以防船体被腐蚀 |
| C. |
钢铁吸氧腐蚀的正极反应:
|
| D. |
工业上电解饱和和食盐水的阳极反应:
|
 请回答氯碱的如下问题:
请回答氯碱的如下问题:
 (1)氯气、烧碱是电解食盐水时按照固定的比率
(1)氯气、烧碱是电解食盐水时按照固定的比率(质量比)生成的产品。理论上
=要求计算表达式和结果);
 (2)原料粗盐中常含有泥沙和
(2)原料粗盐中常含有泥沙和等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①
、②
(盐酸)③
,这3种试剂添加的合理顺序是(填序号)
 (3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
 ①
①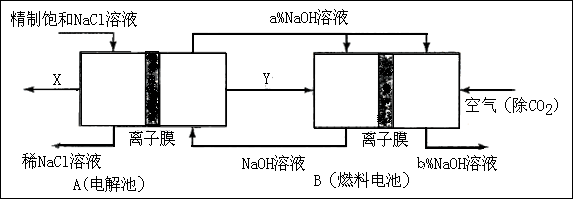
图中分别是、(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小;
 ②分别写出燃料电池
②分别写出燃料电池中正极、负极上发生的电极反应正极:; 负极:;
 ③这样设计的主要节(电)能之处在于(写出2处)、。
③这样设计的主要节(电)能之处在于(写出2处)、。
干电池应用广泛,其电解质溶液是
混合溶液。
 (1)该电池的负极材料是。电池工作时,电子流向(填"正极"或"负极")。
(1)该电池的负极材料是。电池工作时,电子流向(填"正极"或"负极")。
 (2)若
(2)若混合溶液中含有杂质
,会加速某电极的腐蚀,其主要原因是。欲除去
,最好选用下列试剂中的(填代号)。

.
.
.
.
(3)的生产方法之一是以石墨为电极,电解酸化的
溶液。阴极的电极反应式是
 。若电解电路中通过2
。若电解电路中通过2电子,
的理论产量为。