(13分)已知:正盐A强热可得到B、C、D、E四种物质,B通常情况下为无色无味液体,E、F 是空气主要成分,D能产生酸雨,I为红棕色气体,C与J反应可得A,J、K为两种常见的酸。物质之间的转化关系如图所示(图中部分反应物或生成物及反应条件未列出)。 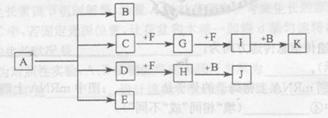
请回答下列问题:
(1)E物质的电子式是________。
(2)检验C的试纸是________,检验D的试剂是________(填试纸、试剂名称)。
(3)写出A强热分解生成B、C、D、E的化学方程式________。
(4)写出D通人FeCl3溶液时,发生反应的离子方程式_____ 。
(5) —定浓度J、K混合后的稀溶液200mL,平均分成两份。向其中一份中逐渐加人铜粉,最多能溶解a g(产生气体只为G)。向另一份中逐渐加人铁粉,产生气体的量随铁粉质量增加的变化如图所示。则①a=________g,②气体G标准状况下体积为________,③J的物质的量浓度为______。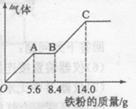
A、B、C、D、E是中学常见的5种化合物,A、B是金属氧化物且A是红棕色固体,元素X、Y、Z是中学化学中常见的单质,相关物质间的关系如下图所示。
(1)工业上得到单质X的冶炼方法1是 。
(2)单质X与试剂1、单质Y与试剂2都能产生Z单质,试剂3是生活中常见的液体,请写出Y与试剂3 反应的化学方程式是 。
(3)若试剂1是NaOH溶液,单质X与试剂1反应的离子方程式 。
(4)若试剂2是盐酸。
①如何检验D物质中的金属阳离子 。
②将D的饱和溶液滴加到沸水中得到有丁达尔效应的分散系,用离子方程式和平衡移动理论说明产生这种分散系的原因 。
由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有下图的转化关系,已知C为密度最小的气体,甲为非电解质。
根据以上转化关系回答下列问题:
(1)写出下列物质的化学式:A B 丁 。
(2)元素A在周期表中的位置是 ,写出甲的一 种用途 。
(3)写出下列变化的方程式:
A与NaOH溶液反应的化学方程式
乙与过量CO2反应的离子方程式
下图表示某些化工生产的流程(部分反应条件和产物略去)
(1)反应Ⅰ需在500℃进行,其主要原因是 。
(2)G转化为H的过程中,需要不断补充空气,其原因是 。
(3)写出反应Ⅲ的化学方程式 。
(4)工业上,向析出K的母液中通氨气,加入细小食盐颗粒,冷却后可析出副产品。通入氨气的作用是 (填序号)。
a.增大NH+4的浓度,使J更多地析出
b.使K更多地析出
c.使K转化为M,提高析出的J的纯度
(5)写出上述流程所涉及的化学工业的名称 。
有A、B、C、D、E、F、G、H、I九种常见物质,它们的转化关系(反应条件未注明)如图所示。常温下A为液态,D为固态,B、C、E、G为气态(C可以使带火星木条复燃),其中B、C、D为单质,F为淡黄色粉末状化合物,I的焰色反应为黄色。
请回答:(1)写出F的电子式 。(2)G的结构式是 。
(3)反应④是 反应(填“吸热”或者“放热”)
(4)写出反应⑤的化学反应方程式
(5)B、C单质已被应用于字宙飞船的燃料电池中,如图所示。若将B换成甲烷也能组成燃料电池(两个电极均由多孔性碳构成),该电池工作时:
①b电极附近溶液的pH将 (填“增大”“减小”“不变”);
②a电极上的电极反应式为: 。
(6)在标准状况下,若将3.36L气体G通入50mL 4mol/L的H溶液中,用一个离子方程式表示其过程:
氢能源是一种重要的清洁能源。现有两种可产生
的化合物甲和乙。将6.00
甲加热至完全分解,只得到一种短周期元素的金属单质和6.72
(已折算成标准状况)。甲与水反应也能产生
,同时还产生一种白色沉淀物,该白色沉淀可溶于
溶液。化合物乙在催化剂存在下可分解得到
和另一种单质气体丙,丙在标准状态下的密度为1.25
。请回答下列问题:
(1)甲的化学式是;乙的电子式是。
(2)甲与水反应的化学方程式是。
(3)气体丙与金属镁反应的产物是(用化学式表示)。
(4)乙在加热条件下与反应可生成
和气体丙,写出该反应的化学方程式。
有人提出产物中可能还含有,请设计实验方案验证之。
(已知)
(5)甲与乙之间(填"可能"或"不可能)发生反应产生,判断理由是。
已知A、B、C、D是中学化学的常见物质,它们在一定条件下有如下转
化关系: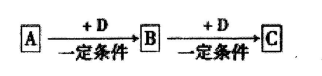
(1)若A为能使湿润的红色石蕊试纸变蓝的气体,C为红棕色气体。则A的空间构型为 ,A转化为B反应的化学方程式为 。
(2)若A、B、C均为氧化物,A为砖红色固体,且A中金属元素为+1价,D是一种黑色固态非金属单质,则A的化学式为 ,B的电子式为 。
(3)若D为氯碱工业的主要产品,B为高中常见的一种具有两性的物质,则C溶液中除氢氧根外还存在的阴离子的化学式为 。氯碱工业中阴极的电极反应式为 。
已知物质A、B、C、D、E、F、G、H、I、J、X、Y有如下图所示的转化关系,其中气体A、B、C为常见非金属单质,X、Y为常见金属单质。(部分反应中生成物没有全部列出,反应条件未全部列出)
请按要求回答下列问题:
(1)气体E的电子式为 ;
(2)G的化学式是___________;
(3)写出反应“I→J”的离子方程式 ;
(4)金属X与NaOH溶液反应也能得到溶液H,试写出对应的化学方程式 。
Ⅰ:某些化学反应可表示为:A+B→C+D+H2O,请回答下列问题:
(1)若A、C、D均含有氯元素,且A中氯元素的化合价介于C与D之间,该反应离子方程式为 。
(2)若A为淡黄色固体,C为无色的气体,则该反应的离子方程式为 。
(3)若A、C、D均是铁的化合物,B是稀硫酸,则A与B反应的化学方程式为 。
Ⅱ:某些化学反应可表示为:A+B+H2O→C+D。请回答下列问题:
(1)若A为非金属单质,C为非金属单质,写出符合要求的化学反应方程式
(2)若A为金属单质,C为非金属单质,写出符合要求的离子方程式_____________________.
根据下图所示的转化关系填空(假设每一步反应的反应物均恰好反应完)
(1)写出反应①的化学方程式: 。
此反应中,氧化剂与还原剂的个数比为 。当有3.2 g气体产生时,消耗淡黄色固体的物质的量是_______mol,固体增重_______g;
(2)写出反应②、③、④的离子方程式:
②
③
④
( 8分)下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属, K是一种红棕色气体。
|

 2Fe2O3+8SO2)
2Fe2O3+8SO2)
A、B、C、D是四种常见单质,其对应元素的核电荷数依次增大,其中B、D属于常见金属,E、F、G化合物。所有物质之间有如下的转化关系:



(1)写出D→A+F的化学方程式: ;
(2)写出B→A+E的离子方程式: 。
(3)将G的饱和溶液滴入沸水中可形成红褐色的透明液体,再将此液体装入U型管,并在U型管的两端插入电极,接通直流电,在阳极端可观察到的现象是___________________;
(4)向含0.1 mol E的溶液中滴加5 mol/L 的盐酸溶液,得到沉淀3.9 g,则加入盐酸体积为 mL。
A、B、C、W、X、Y、Z是由周期表中短周期元素组成的七种物质,其中A、B、C是三种固体单质,W、X、Y、Z是由两种元素组成的化合物。它们之间的转化关系如图所示(所有反应物和生成物均未在框图中: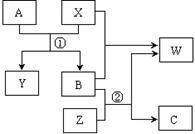
回答下列问题:
(1)化合物Z的晶体类型属于__________晶体。
(2)写出单质C的一种用途__________________________________。
(3)航天科技测知化合物N是金星大气层的成分之一,组成化合物N的元素与W相同。已知N中两种元素的质量之比为2:1,N的相对原子质量小于80,则N的化学式为_____________。又知该分子中的每个原子都满足最外层8电子的稳定结构,试写出其电子式_________________。
(4)写出下列反应的化学方程式:
①__________________________________;
②__________________________________。
下图是一些物质间的转化关系图,图中所有物质含有的元素中只有一种不是短周期元素,所有反应物、生成物及溶液中的水以及部分反应中一些生成物未标出。C、D、E、K为单质,N为两性化合物。J是由两种元素组成的和SiC相同晶体类型的新型材料,且J和SiC具有相同的价电子数和原子数。I是由四种元素组成的强碱。反应③用于检验一种常见的有机官能团,反应⑤、⑥用于工业中生产B。
回答下列问题:
(1)写出下列物质的化学式:G 、I 。
(2)写出反应①、⑦的离子方程式:
① ,
⑦ ;
(3)J和SiC的纳米级复合粉末是新一代大规模集成电路理想的散热材料。反应②是日本科学家研究开发制备该纳米级复合粉末的最新途径。已知反应②中n(F)∶n(E)∶n(J)∶n(SiC)∶n(K)=1∶2∶4∶1∶3,写出反应②的化学方程式 。
已知A是生产生活中用量最大的金属,B为淡黄色粉末。在常温下C为无色液体,E、G、H、I、J为气体,其中H为黄绿色,其它为无色。J能使湿润的红色石蕊试纸变蓝(图中部分产物已略去)。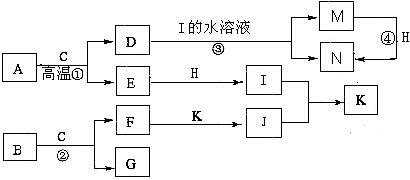
请填写下列空白
(1)写出化学式:D ,K 。
(2)写出②的离子方程式 。
(3)反应④不属于下列何种反应类型 (填字母序号)。
A. 化合反应 B. 氧化还原反应 C. 离子反应 D. 置换反应
(4)若要确定③反应后所得溶液中含有M物质,所选试剂为 (填序号)。
A. KSCN溶液和氯水 B. 铁粉和KSCN
C. 浓氨水 D. 酸性高锰酸钾溶液
(5)将F加入到M的溶液里并露置在空气中,可以观察到整个过程的现象是:
。
(6)常温下,H与过量的J反应产生浓厚的白烟,另一生成物是空气的主要成分之一,请写出该反应的化学方程式 。