中学常见反应的化学方程式是:A+B→X+Y+H2O(未配平,反应条件略去),其中,A、B的物质的量之比为1:4。请回答:
(1)若Y是黄绿色气体,该反应的离子方程式是 。
(2)若A为常见的非金属单质,B的溶液为某浓酸,其氧化产物的结构式为 ______
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中。
①A元素在周期表中的位置是 (填所在周期和族)
②含 a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,被还原的X
是 mol。
(4)若A、B、X、Y均为化合物。向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色。则A与B按物质的量之比1:4反应后,溶液中溶质的化学式为 。
置换反应可用下图表示,回答下列问题:
(1)若甲为黄绿色气体,单质乙能使淀粉溶液变蓝色,则该反应的离子方程式为
。
(2)若过量单质甲与化合物A发生反应的化学方程式为:2Al+Fe2O3 Al2O3+2Fe, 除去反应后混合物中剩余的铝粉与生成的Al2O3所用的试剂是 ,写出铝粉与所用试剂反应的离子方程式 。
Al2O3+2Fe, 除去反应后混合物中剩余的铝粉与生成的Al2O3所用的试剂是 ,写出铝粉与所用试剂反应的离子方程式 。
(3)工业上利用置换反应原理制备一种半导体材料,写出该反应的化学方程式
。
(4)若单质乙是黑色非金属固体单质,化合物B是优质的耐高温材料,则该反应的化学方程式为 。
生铁中一般含有化合物B,B只有两种元素组成,它的含量、形状、分布对生铁性能影响很大,使生铁硬而脆,不宜进行机械加工。已知:(1)E、F、H、I、P常温下为气体,H、I、P为单质,E是一种红棕色气体。(2)反应①②均为制备理想的绿色水处理剂Na2FeO4的方法,其中反应①在生成Na2FeO4同时还生成NaNO2和H2O。各物质之闻的转化关系如下图所示f图中部分生成物没有列出)。
请填写以下空白:
(1)用电子式表示F的形成过程_________________________________________
(2)按要求完成下列反应:__________________________________________
反应③的离子方程式为________________________________________
反应①的化学方程式为________________________________________
(3)反应②中氧化剂与还原剂的物质的量比为__________________________________
反应④中的氧化产物的化学式为_______________________________________
(4)实验室中检验C溶液中金属阳离子的常用方法是________________________
(5)如果A与B反应时生成E与F的物质的量比为13:1,则化合物B的化学式为__________
在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)。回答下列问题:
(1)在反应②中,每生成 2.24L 气体G(标准状况)时,该反应转移电子的物质的量是 mol。
(2)若反应①在加热条件下进行,单质A和化合物B按物质的量之比为1:2发生反应,且C、D是两种均能使澄清的石灰水变浑浊的无色气体,则反应①的化学方程式是 。
(3)若反应①在溶液中进行,A是一元强碱,B是一种酸式盐,D是一种使湿润红色石蕊
试纸变蓝的气体,且B遇盐酸能生成使品红溶液褪色的气体。在加热条件下,当A过量时,
反应①的离子方程式是 。
氢能源是一种重要的清洁能源。现有两种可产生 的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 L的
的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 L的 (已折算成标准状况)。甲与水反应也能产生
(已折算成标准状况)。甲与水反应也能产生 ,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到
,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到 和另一种单质气体丙,丙在标准状态下的密度为1.25g·L-1。请回答下列问题:
和另一种单质气体丙,丙在标准状态下的密度为1.25g·L-1。请回答下列问题:
(1)甲的化学式是_________;乙的空间构型是__________。
(2)甲与水反应的化学方程式是__________________________________。
(3)气体丙与金属镁反应的产物是_______(用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式________ 有人提出产物Cu中可能还含有Cu2O,请设计实验方案验证之
_________________________。
(已知Cu2O+2H+==Cu+Cu2++H2O)
(5)甲与乙之间_______(填“可能”或“不可能)发生反应产生 ,判断理由是
,判断理由是
_______ _ 。
中学化学中常见的几种物质存在下图所示的转化关系。其中,A是一种黑色粉末状固体,C是一种黄绿色气体,实验室中常用E溶液吸收多余的C。(图中部分产物和反应条件已略去)
回答下列问题:
(1)写出A与B的浓溶液反应的化学方程式 。
(2)固体E中含有化学键的类型是 ,C与E反应的离子方程式为 。
(3)将B的浓溶液与H的浓溶液混合,立即产生大量气体C,该反应的离子方程式为 。
(4)某课外小组的同学用E溶液吸收C,利用下图所示装置向吸收液中持续通入SO2气体。
实验过程中观察到如下现象:
①开始时,溶液上方出现白雾,试纸a变红。甲同学认为是HCl使a变红,乙同学不同意甲的观点,乙同学的认为使a变红的是 (写出一种即可)。
②片刻后,溶液上方出现黄绿色气体,试纸b变蓝。用离子方程式解释b变蓝的原因 。
③最终试纸b褪色。同学们认为可能的原因有两种:一是I2有还原性,黄绿色气体等物质将其氧化成
IO3-,从而使蓝色消失;二是 。
已知A经如右图所示的过程转化为D, 
请回答下列问题:
(1)若A为非金属单质,且常温下为淡黄色固体,B为刺激性气味的无色气体,能使品红溶液褪色,D为强酸。
①D的化学式是 。
②在工业生产中B气体的大量排放被雨水吸收后形成了 而污染了环境。某工厂净化残余的B气体装置如图,则除去B气体的总反应方程式是 。
(2)若A是能使酚酞试液变红的气体。D是一种强酸。写出A→B的化学方程式 ;工业生产上,以34吨A为原料,最多可以生产63%的D酸 吨。
已知A是生产生活中用量最大的金属,B为淡黄色粉末。在常温下C为无色液体,E、G、H、I、J为气体,其中H为黄绿色,其它为无色。J能使湿润的红色石蕊试纸变蓝(图中部分产物已略去)。
请填写下列空白
(1)写出化学式:D ,K 。
(2)写出②的离子方程式 。
(3)反应④不属于下列何种反应类型 (填字母序号)。
A.化合反应 B.氧化还原反应 C.离子反应 D.置换反应
(4)若要确定③反应后所得溶液中含有M物质,所选试剂为 (填序号)。
A.KSCN溶液和氯水 B.铁粉和KSCN
C.浓氨水 D.酸性高锰酸钾溶液
(5)将F加入到M的溶液里并露置在空气中,可以观察到整个过程的现象是:
。
(6)常温下,H与过量的J反应产生浓厚的白烟,另一生成物是空气的主要成分之一,请写出该反应的化学方程式 。
构建知识网络是学习化学的重要方法。下列物质的转化网络可以概括几类反应,其中A、B、D、E、M、N、X、Y均表示一种中学化学中常见的无机物,反应②、③、④、⑤
的生成物可以是一种或几种。请回答下列问题:
(1)A为固态非金属单质时,若反应①用于生产半导体材料,则M为________ Y为 。
(2)A为金属单质时,若M为NaAlO2溶液,N为棕黄色溶液,反应⑤的离子方程式是 。
(3)反应①在常温下进行时,也有很多组物质符合网络图中的转化关系,请列举一例(要求反应①中只有一种元素的化合价发生变化):A、B的化学式分别是 。
已知常温下B、D、E、L为密度比空气大的气体,D、E为单质,其他为化合物。A是一种淡黄色固体,C微溶于水,F、G均能与L的水溶液反应放出B。据下边反应框图填空。
(1)F的俗名是 ,B分子的结构式为________工业上利用反应③生产 。
(2)反应④的离子方程式为 。
(3)有一种单质能与H反应生成E,该反应的化学方程式为 。
(4)某气体M具有漂白作用,既有氧化性,又有还原性,M通入D的溶液中反应的离子方程式为 。
(已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素。在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去)。
请回答下列问题:
若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质
①加热蒸干B的溶液不能得到B,则B的化学式可能是________________;工业上制取A的离子方程式为__________________________________。
②用A制备漂白粉的化学方程式是________________________________________________。反应②的离子方程式是______________________________________________________,配制C的溶液时可加入少量的______(填物质名称)以抑制水解。
(2)若A是某强酸的稀溶液,则A的化学式可能是________。
(3)若D是氯碱工业的主要产品之一,B有两性,则反应②的离子方程式是________________________。
(4)若A、B、C的的焰色反应都呈黄色,D是气态酸性氧化物,则D可能是______或______(填化学式),鉴别这两种气态酸性氧化物常可选用________________(填一种试剂名称)。
A、B、C、D、E为五种元素的单质,其余为化合物。其中只有E为金属元素,五种元素的原子序数按B、D、C、A、E顺序依次增大,D、C元素在周期表中位置相邻,在一定条件下,B分别和A、C、D化合生成甲、乙、丙,乙、丙每个分子中均含有10个电子;C和D化合可得丁。各物质相互转化关系如下图:
请回答下列问题:
(1)写出E元素在周期表的位置 。
(2)戊的名称为_________________;用途 (只写一种)。
(3)写出实验室制取A反应的离子方程式_________________________________。
(4)常温下A与足量的丙发生反应生成单质D,写出该反应的化学方程式
____________________________________________________________________。
(5)写出足量E和稀硝酸反应的化学方程式:
_______________________________________________________________________。
(6)实验室配制庚溶液的方法是______________________________________________。
有①、②、③、④、⑤、⑥、⑦、⑧、⑨、⑩十种元素,原子序数依次增大,⑨、⑩处于第四周期,其余均为短周期元素。
(1)若②、⑦、⑧三种元素在周期表中相对位置如下
| ② |
|
|
|
| |
|
⑦ |
⑧ |
②与⑧形成的液体化合物是常见的溶剂,则⑦元素在周期表中的位置是 ,②元素的氧化物的电子式是 ,②与⑧形成的化合物中存在的化学键是 ,则②、⑦、⑧三种元素最高价氧化物对应的水化物酸性由弱到强的顺序是 (用化学式表示)。⑦、⑧两种元素形成的阴离子半径大小顺序是 (用离子符号填)。
(2)若甲、己、丙、丁、戊均为上述短周期元素中组成的单质或化合物,且甲、乙、丙为无色气体,戊为红棕色气体。根据下图所示转化关系推测:
①写出反应a的化学方程式: 。
②写出戊与丁反应的化学方程式: 。
(3)若下图中A、B、C、D、E分别是上述10种元素组成的单质或化合物。
①若反应c是用A作电解池的阳极,电解B的水溶液,其中A是红色金属单质,E是具有黄绿色的气体。则反应d中阴极的电极反应式为: 。
②若反应c是在高温下进行的。其中B是暗红色固体,当物质C是一种两性化合物,则反应c的化学方程式为 。
下图是常见物质间的反应关系,其中并且部分产物已被略去。常温下X为固体、B为液态,其余为气体。X受热分解生成A、B、C的物质的量相等。根据图中关系: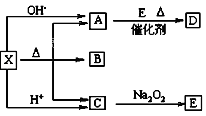
(1)推断化学式:X ;A ;B ;D 。
(2)写出C→E反应的化学方程式 。
(3)写出X→A反应的离子方程式(OH-足量) 。
(4)治疗心绞痛的药物三硝酸甘油酯,在人体体液中的酶的作用下,缓慢氧化自发释放出D分子,同时生成二氧化碳和水,写出该反应的化学方程式: 。