[北京]2014届北京市海淀区高三上学期期中考试化学试卷
下列说法正确的是
| A.16O和18O互为同位素 | B.漂粉精、液氯、干冰均为混合物 |
| C.稀硫酸、氨水均为电解质 | D.溶于水能电离出H+ 的物质一定是酸 |
下列叙述不正确的是
| A |
B |
C |
D |
 |
 |
  |
 |
| 闪电时会发生反应: N2+O2  2NO 2NO |
利用丁达尔效应证明烧杯中的分散系是胶体 |
蔗糖中加入浓硫酸搅拌后变黑,因为浓硫酸有吸水性 |
加热时熔化的铝不滴落,证明Al2O3的熔点比Al高 |
如图是元素周期表的一部分,下列关系正确的是
| S |
Cl |
| Se |
Br |
A.还原性:Se2->S2->C1- B.热稳定性:HC1>H2Se>HBr
C.原子半径:Se>C1>S D.酸性:HBrO4>HClO4>H2SO4
下列说法不正确的是
| A.柠檬虽然酸味较浓,但属于碱性食物 |
| B.向煤中加入适量的石灰石,可以减少燃烧产物中SO2的量 |
| C.氧化铝是冶炼金属铝的原料,也是一种比较好的耐火材料 |
| D.石英是良好的半导体材料,可以制成光电池,将光能直接转化成电能 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.1mol Na2O2固体中含有O22-2 NA |
| B.常温常压下,3.2 g CH4中含有电子2 NA |
| C.标准状况下,11.2 L CH3CH2OH中含有分子0.5NA |
| D.100 mL 1 mol·L-1的CH3COOH溶液中含有CH3COOH分子0.1 NA |
下列叙述不正确的是
A.用电子式表示HCl的形成过程: |
B. 中的原子核内的中子数与核外电子数之差是99 中的原子核内的中子数与核外电子数之差是99 |
C.在空气中加热金属锂:4Li+O2 2Li2O 2Li2O |
D.铝热法炼铁:2Al+Fe2O3 2Fe+ Al2O3 2Fe+ Al2O3 |
在pH=13的无色溶液中,下列各组离子能大量共存的是
| A.K+、Na+、HCO3- 、NO3- | B.Na+、NH4+、NO3-、Cl- |
| C.K+、Na+、NO3-、Br - | D.K+、Cu2+、Cl-、SO42- |
向某无色溶液中分别进行下列操作,所得现象和结论正确的是
| A.加入氨水,产生白色沉淀,证明原溶液中存在Al3+ |
| B.加入AgNO3溶液,产生白色沉淀,证明原溶液中存在Cl- |
| C.加入盐酸酸化的BaCl2溶液,生成白色沉淀,证明原溶液中存在SO42- |
| D.加入NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,证明原溶液中存在NH4+ |
用如图所示装置进行实验,下列对实验现象的解释不合理的是
| |
①中试剂 |
①中现象 |
解 释 |
| A |
Ba(NO3)2溶液 |
生成白色沉淀 |
SO32-与Ba2+生成白色BaSO3沉淀 |
| B |
品红溶液 |
溶液褪色 |
SO2具有漂白性 |
| C |
紫色石蕊溶液 |
溶液变红 |
SO2与水反应生成酸 |
| D |
酸性KMnO4溶液 |
紫色褪去 |
SO2具有还原性 |
下列离子方程式书写正确的是
| A.Cu(OH)2中加入硫酸:OH-+H+ =H2O |
| B.钠加入水中:Na +2H2O=Na++2OH-+H2↑ |
| C.FeSO4溶液中加入稀硝酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ |
| D.Al2(SO4)3溶液中加入足量Ba(OH)2溶液:2Al3++3SO42-+ 3Ba2++6OH- =2Al(OH)3↓+3BaSO4↓ |
下列图中的实验方案,能达到实验目的的是
| |
A |
B |
C |
D |
| 实验方案 |
 |
 将NO2球浸泡在冰水和热水中 |
 |
 |
| 实验 目的 |
验证FeCl3对H2O2分解反应有催化作用 |
探究温度对平衡 2NO2  N2O4的影响 N2O4的影响 |
除去CO2气体中混有的SO2 |
比较HCl、H2CO3和H2SiO3的酸性强弱 |
已知下列实验事实:
①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;
②向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液;
③将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝。
下列判断不正确的是
| A.化合物KCrO2中Cr元素为+3价 |
| B.实验①证明Cr2O3是两性氧化物 |
| C.实验②证明H2O2既有氧化性又有还原性 |
| D.实验③证明氧化性:Cr2O72- > I2 |
已知反应X (g)+Y (g)  n Z (g) △H > 0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是
n Z (g) △H > 0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是
| A.反应方程式中n=1 |
| B.10 min时,曲线发生变化的原因是升高温度 |
| C.10 min时,曲线发生变化的原因是增大压强 |
| D.0~5 min内,用X表示的反应速率为v(X)="0.08" mol·L-1·min-1 |
X、Y、Z、W、R是短周期元素,原子序数依次增大。X原子核外各层电子数之比为1:2, Y原子和Z原子的核外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。
请回答下列问题:
(1)元素X的最高价氧化物的电子式为 ;元素Z的离子结构示意图为 。
(2)单质铜和元素Y的最高价氧化物对应水化物的稀溶液发生反应的化学方程式为 。
(3)元素W位于周期表的第 族, 其非金属性比元素R弱,用原子结构的知识解释原
因 。
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液做其吸收剂,写出吸收剂
与足量该氧化物反应的离子方程式 。
(5)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在
高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1:3,则该反应的化学方程式为 。
中学化学中常见的几种物质存在下图所示的转化关系。其中,A是一种黑色粉末状固体,C是一种黄绿色气体,实验室中常用E溶液吸收多余的C。(图中部分产物和反应条件已略去)
回答下列问题:
(1)写出A与B的浓溶液反应的化学方程式 。
(2)固体E中含有化学键的类型是 ,C与E反应的离子方程式为 。
(3)将B的浓溶液与H的浓溶液混合,立即产生大量气体C,该反应的离子方程式为 。
(4)某课外小组的同学用E溶液吸收C,利用下图所示装置向吸收液中持续通入SO2气体。
实验过程中观察到如下现象:
①开始时,溶液上方出现白雾,试纸a变红。甲同学认为是HCl使a变红,乙同学不同意甲的观点,乙同学的认为使a变红的是 (写出一种即可)。
②片刻后,溶液上方出现黄绿色气体,试纸b变蓝。用离子方程式解释b变蓝的原因 。
③最终试纸b褪色。同学们认为可能的原因有两种:一是I2有还原性,黄绿色气体等物质将其氧化成
IO3-,从而使蓝色消失;二是 。
某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊。A受热分解的化学方
程式为 。
(2)称取两种固体各2 g,分别加入两个小烧杯中,再各加10 mL 蒸馏水,振荡,测量温度变化;待
固体充分溶解,恢复至室温,向所得溶液中各滴入2滴酚酞溶液。
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论 。
②同学们在两烧杯中还观察到以下现象。其中,盛放Na2CO3的烧杯中出现的现象是 (填字母序号)。
a.溶液温度下降 b.溶液温度升高
c.滴入酚酞后呈浅红色 d.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中。
①两试管中均产生气体, (填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈。
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是 。
a.装置Ⅰ的气球体积较大 b.装置Ⅱ的气球体积较大
c.生成气体的体积根据盐酸计算 d.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成0.5 mol·L-1的溶液,设计如下方案并对反应现象做出预测:
| 实验方案 |
预测现象 |
预测依据 |
| 操作1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 |
有白色 沉淀 |
Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应 (写离子方程式)。 |
| 操作2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 |
无白色 沉淀 |
NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应。 |
实施实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体。则该条件下,NaHCO3溶液与
CaCl2溶液反应的离子方程式为 。
某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,该厂用上述废金属屑制取新型高效水处理剂Na2FeO4(高铁酸钠)等产品,过程如下:
I.向废金属屑中加入过量的NaOH溶液,充分反应后过滤;
II.向I所得固体中加入过量稀H2SO4,充分反应后过滤;
III.向II所得固体中继续加入热的稀H2SO4,同时不断鼓入空气,固体溶解得CuSO4溶液;
IV.(1)步骤I中发生反应的化学方程式为 、 。
(2)步骤II所得的滤液中加入KSCN溶液无明显现象,表明滤液中不存在Fe3+,用离子方程式解释其
可能的原因 。
(3)步骤III获得CuSO4溶液的离子方程式为 。
(4)步骤II所得滤液经进一步处理可制得Na2FeO4,流程如下:
①测得滤液中c(Fe2+) 为a mol·L-1,若要处理1 m3滤液,理论上需要消耗25 % 的H2O2溶液_________kg
(用含a的代数式表示)。
②写出由Fe(OH)3制取Na2FeO4的化学方程式___________。
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
| 温 度(℃) |
360 |
440 |
520 |
| K值 |
0.036 |
0.010 |
0.0038 |
(1)①写出工业合成氨的化学方程式 。
②由上表数据可知该反应为放热反应,理由是 。
③理论上,为了增大平衡时H2的转化率,可采取的措施是 。(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应 CH4(g)+H2O (g) CO(g)+3H2(g) 获取,已知该反应中,当初始混合气
CO(g)+3H2(g) 获取,已知该反应中,当初始混合气
中的 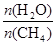 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示: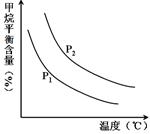
①图中,两条曲线表示压强的关系是:P1 P2(填“>”、“=”或“<”)。
②该反应为 反应(填“吸热”或“放热”)。
(3)原料气H2还可通过反应CO(g)+H2O(g) CO2 (g)+H2(g) 获取。
CO2 (g)+H2(g) 获取。
①T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度
为0.08 mol·L-1,则平衡时CO的转化率为 ,该温度下反应的平衡常数K值为 。
②保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说
明体系处于平衡状态的是 (填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n (CO) : n (H2O) : n (CO2) : n (H2)=1 : 16 : 6 : 6




 粤公网安备 44130202000953号
粤公网安备 44130202000953号